Аналитический контроль качества титаната бария
По технологии с использованием неорганических веществ возможно получать титанаты щелочноземельных металлов; делались попытки получения твердых растворов соединений. Для синтеза титаната бария к водному раствору хлорида титана при непрерывном перемешивании добавляют водный раствор осадителя (NH4OH, NaOH и др.) Затем к суспензии образующегося гидроксида добавляют при перемешивании водный раствор, содержащий катионы Ba2+ (в частности BaCl2). Образующийся осадок фильтруют, промывают, высушивают и прокаливают. Процесс может быть выражен следующей схемой:
TiOCl2 · nH2O + Ba2+ + 2Cl- + 2NH4OH → y BaO · TiO2 · nH2O + 2NH4Cl
Полученный после промывки и сушки порошок имеет высокую удельную поверхность, до 200 м2/г; величина Sуд резко уменьшается с повышением температуры и времени термообработки. Уменьшении Sуд происходит как за счет увеличения размера частиц, так и за счет образования агломератов частиц. [1] По современным представлениям, высокая чистота, структура и субмикронная дисперсность материалов определяют электрофизические параметры и стабильность изделий на их основе. Наиболее перспективными для синтеза подобных материалов являются методы, основанные на химических реакциях в жидкой фазе с выделением продуктов реакции в осадок. Особенность этих методов заключается в том, что синтез материалов осуществляют как «интегрирование» зерен материала, начиная с молекулярного уровня. Наиболее интересной в этом отношении является золь – гель технология из алкоксидов металлов, позволяющая получать как простые, так и сложные композиционные материалы. Титанат бария является основой для большинства керамических конденсаторных материалов. Технология алкоксидного синтеза включает в себя следующие стадии:
- приготовление смешанных сложных растворов в органическом растворителе, включающих в себя все элементы будущих оксидных соединений в необходимой пропорции;
- гидролиз растворов;
термообработка продуктов гидролиза. Золь – гель метод применяли в реакциях гидролиза: а) смеси алкоксидов титана и бария, б) двойных алкоксидов титана и бария, в) алкоксида титана в растворе гидроксида бария. Бутоксид титана Ti(OR)4 (квалификации «чистый» ) перегоняли под вакуумом. Изопропоксид бария Ba(i-C3H7O)2 синтезировали растворением металлического бария в изопропиловом спирте (1). Реакцию проводили в атмосфере сухого аргона в колбе с обратным холодильником, снабженным трубкой с хлоридом кальция (во избежание гидролиза). Изопропиловый спирт обезвоживали кипячением над свежепрокаленным оксидом кальция и последующей двукратной перегонкой. Синтез проводили в избытке спирта при температуре 30 – 40º С. Для получения титаната бария BaTiO3 смешивали расчетные по стехиометрии количества Ba(OR)2 и Ti(OR)4, затем проводили гидролиз деионизованной водой:
Ba(i-C3H7O)2 + Ti(OC4H9)4 + 3H2O → BaTiO3 + 2C3H7OH + 4C4H9OH (1)
Белый рыхлый порошок отделяли от раствора центрифугированием или фильтрованием, высушивали на воздухе.
Вторая серия образцов титаната бария была получена гидролизом двойных алкоксидов MIIMIV(OR)x. Навеску металлического бария вводили в рассчитанное по стехиометрии количество бутоксида титана Ti(OC4H9)4, растворенного в бутиловом спирте (2):
Ba + Ti(OC4H9)4 + 2C4H9OH → BaTi(OC4H9)6 + H2↑. (2)
Реакция начиналась сразу после небольшого нагрева смеси, процесс шел в токе предварительно осушенного инертного газа. В результате реакции (2) образовывался мутный с желтоватым оттенком раствор, добавление к которому деионизованной воды приводило к интенсивному осаждению белого творожистого осадка. Полученный осадок сушили и прокаливали при 600 – 650º С на воздухе. Проведено исследование влияния условий гидролиза: мольного соотношения алкоксид: вода, температуры воды и рН – на структуру и состав титаната бария. Изучение структуры и фазового состава синтезированного титаната бария осуществляли с помощью электронного микроскопа УЕМ–120, растрового УМ-2, электронографа ЭРМ-100. По результатам исследований установлено, что минимальные размеры структурных элементов BaTiO3 составляют (30 – 50) · 10-3 мкм. Синтез титаната бария гидролизом алкоголята титана в растворе гидроксида бария осуществлялся по следующей схеме:
Ti(OR)4 + 4H2O + Ba2+ + 2(OH)ˉ →
Ti(OH)62- + Ba2+ + 4ROH → BaTiO3 + 4ROH + 3H2O
Раствор алкоксида титана (тетра-н.-бутоксититан) в изопропиловом спирте вводили в раствор гидроксида бария при интенсивном перемешивании, реакционную смесь выдерживали при 80 – 90º С в течение 2 ч. Затем следовали стадии вызревания осадка, фильтрования, сушки и прокаливания. Выбор гидроксида бария определен тем, что для протекания реакции образования метатитаната бария требуется щелочная среда. Концентрация алкоксида титана в изопропиловом спирте должна быть не более 100 г/л, так как исследования показали, что использование более высоких концентраций уменьшает соотношение BaO : TiO2 в готовом продукте. При низких температурах получаются кислые титанаты, увеличение температуры до 85 – 90º С позволяет получать титанат бария стехиометрического состава. Интенсивное перемешивание, быстрое введение алкоксида способствуют получению мелкодисперсного аморфного продукта. Порошки титаната бария полидисперсны; данные, полученные электронной микроскопией, позволяют определить, что размер единичных частиц составляет не более 0.5, а агрегатов – не более 5 мкм. Анализ дифрактограмм порошков, высушенных на воздухе и в вакууме при температуре 100 – 250º С, показал, что происходит формирование кристаллической структуры титаната бария. При сушке титаната бария на воздухе параллельно идет образование карбоната бария, резко снижающего выход стехиометрического продукта. Титанат бария, высушенный под вакуумом, имел четкую кристаллическую структуру перовскита, не содержащую карбоната бария. [3] Гидротермальный метод основан на реакциях гетерогенного взаимодействия, протекающих в специальных условиях между гидроксидами или оксидами титана, находящимися в твердой фазе, и ионами металлов, присутствующими в растворах солей или оснований. В качестве специальных условий выступают высокая температура (200 – 400º С) и высокое давление ( до 300 – 500 атм), т.е. реакция проходит в автоклавах. При использовании гидроксидов образование титаната бария описывается реакцией:
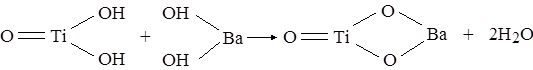
Исследование кинетики этой реакции показывает, что получение BaTiO3 происходит без образования промежуточных фаз. Для выделения полученного соединения необходима сушка или термообработка осадка. [1] Также гидротермальным методом в щелочном водном растворе Ba(NO3)2 и Ti(OC4H9)4 при 240º С синтезирован тетрагональный BaTiO3. Методами рентгенодифрактометрии, ДСК и ИК – спектроскопии исследовано влияние щелочности, концентрации нитрат- ионов и реакционной способности титанового источника на образование, размер частиц и морфологию продукта. Установлено, что при оптимальной концентрации КОН (1,0 М) BaTiO3 является наиболее устойчивой фазой в ряду BaO – TiO2. Нитрат- ион играет положительную роль в образовании и росте качественных кристаллов BaTiO3. Высокие реакционные способности титановых источников облегчают образование тетрагонального продукта. [4] Методами дифференциальной сканирующей калориметрии, термогравиметрии и рентгенографии при нагревании в интервале температур 20 – 900º С изучено получение BaTiO3 совместным пиролизом резинатов бария и титана. Определен фазовый состав продуктов постадийной термообработки. Показано, что в процессе совместного пиролиза резинатов бария и титана при температуре больше 600º С образуется метатитанат бария.[5] Химический синтез исходных соединений не исчерпывается перечисленными методами.
