Белки и нуклеиновые кислоты
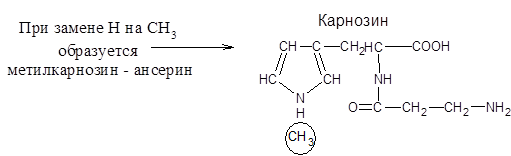
Эти дипептиды служат для поддержания постоянного рН в клетках мышц, т.е действуют как буферы, также они участвуют в сокращении мышц, в процессах окислительного фосфорилирования т.е в образовании АТФ.
Глутатион (g-глутамилцистеинилглицин) – трипептид, присутствует во всех животных, растениях и микроорганизмах.
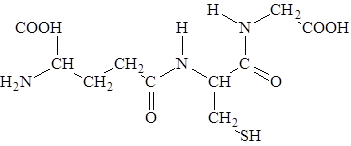
Отличительная структурная особенность глутатиона, состоит в том, что глутаминовая кислота в составе этого пептида представляет для образования пептидной связи g-карбоксильную (а не a-карбоксильную группу). Существуют две формы глутатиона восстановленная (SH-глутатион) и окисленная (S-S-глутатион). Взаимопревращения одной формы в другую катализируется ферментом глутатионредуктазой.
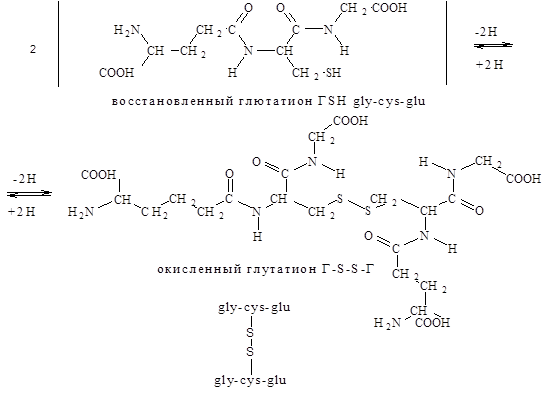
В настоящее время известны лишь некоторые из физиологических функций глутатиона:
1) участие в транспорте аминокислот через клеточные мембраны;
2) поддержание восстановленного состояния железа (Fe+2) в гемоглабине;
3) входит в состав фермента глутатионпероксидазы, который защищает клетки от разрушающего действия Н2О2.
4) участвует в детоксикации ряда чужеродных для живой клетки соединений (галогенсодержащие алифатические или ароматические углеводороды) переводит их в водорастворимые соединения, которые выводятся из организма почками.
5) восстановленный глутатион защищает SH-группы белка от окисления, сам при этом превращается в окисленный.
Глутатион влияет и на технологические свойства зерна и муки. Восстановленный глутатион вызывает восстановление и разрыв дисульфидных связей в молекуле белков клейковины, т.е разрушает ее. Тесто из такой муки обладает плохими структурно-механическими свойствами), оно ослабляется, расплывается из него нельзя получить хлеб нормального качества.) Много глутатиона в старых дрожжах и зародышах зерновых, что следует учитывать в хлебопечении. Восстановленный глутатион способен активировать протеиназы (ферменты ращепляющие белки) зерна и муки, при этом начинается усиленно протекать протеолиз белков клейковины и вызванное им разжижение теста. Глутатион способствует накоплению в пиве азотистых соединений сравнительно большой молекулярной массы, что вызывает образование мути в пиве и ухудшает его потребительские свойства.
С 1981г. разрешено использовать в качестве низкокалорийной добавки для придания продуктам сладкого вкуса аспартам (торговое название). Аспартам в 200 раз слаще сахара и представляет собой метиловый эфир дипептида, состоящего из остатков аспарагиновой кислоты и фенилаланина.
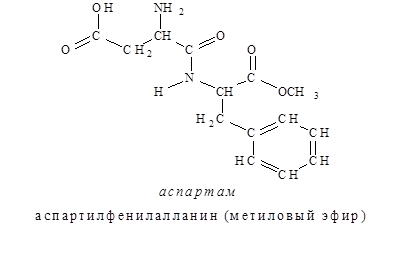
У млекопитающих (в том числе у человека) вырабатываются пептиды обладающие гормональным регуляторным действием, причем диапазон приложения их действия и эффективность в организме очень разнообразны. Например, два циклических нонапептида вырабатывает гипофиз. Окситоцин стимулирует сокращение матки у беременных самок и выделение молока у кормящих самок. Вазопрессин обладает сильным антидиуретическим действием и участвует в контроле кровяного давления. Соматостатин – один из гормонов гипоталамуса – ингибирует синтез гормона роста человека в гипофизе, что приводит к задержке роста и развития тела.
В 1975г. открыта группа пептидов, которые оказывают влияние на передачу нервных импульсов. Их также называют опиатными пептидами, поскольку механизм их действия сходен с механизмом действия морфина и других опиоидов. Они присутствуют в очень малых количествах, как у позвоночных, так и у беспозвоночных. Эти вещества обладают сильным обезболивающим действием, а также участвуют в регуляции настроения и поведения.
1.7 Белки
Полипептиды, содержащие больше 51 аминокислоты, относятся к белкам. Белки входят в состав всех клеток и тканей живых организмов. Около 50% сухого вещества клетки приходится на белки.
Белки характеризуются определенным элементарным составом. Химический анализ показал наличие во всех белках углерода (50-55%), кислорода (21-24%), азота (15-18%), водорода (6-7%), серы (0,3-2,5%). В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро и микроэлементы, в различных, часто очень малых количествах.
Белками (протеинами, от греческого protas – первый, важнейший) называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот.
Поразительно то, что все белки во всех организмах построены их одного и того же набора – 20-ти аминокислот, каждая из которых не обладает никакой биологической активностью. Что же тогда придает белку специфическую активность, одним ферментативную, другим, гормональную, третьим защитную и т.д.
Ответ довольно прост: белки отличаются друг от друга тем, что каждый имеет свою характерную для него аминокислотную последовательность.
Аминокислоты – это алфавит белковой структуры; соединив их в различном порядке можно получить бесконечное число последовательностей, а, следовательно, и бесконечное количество разнообразных белков, выполняющих различные биологические функции.
1. Ферментативная (каталитическая). В биологических системах почти все реакции катализируются специфическими белками – ферментами. В настоящее время открыто около 300 различных ферментов, каждый из которых служит катализатором определенной биологической реакции. Синтез и распад веществ, их регуляция, перенос химических групп и электронов от одного вещества к другому осуществляется с помощью ферментов.
2. Строительная, структурная функция. Белки образуют основу протоплазмы любой живой клетки, в комплексе с липидами они являются основным структурным материалом всех клеточных мембран всех органелл.
3. Двигательная функция. Любые формы движения в живой природе (работа мышц, движение ресничек и жгутиков у простейших, движение протоплазмы в клетке и т.д.) осуществляется белковыми структурами.
4. Транспортная функция. Перенос различных молекул, ионов осуществляется специфическими белками. Например, белок крови гемоглобин переносит кислород к тканям. Перенос жирных кислот по организму происходит с участием другого белка крови-альбумина.
5. Регуляторная функция. Регуляция углеводного, белкового, липидного обменов осуществляется с помощью гормонов, которые по своему строению относятся к белкам (инсулин) или пептидам (окситоцин, вазопрессин и др.).
6. Защитная – эту функцию выполняют иммуноглобулины (антитела). Они обладают способностью обезвреживать бактерии, вирусы, чужеродные белки, попавшие в организм извне. Процесс свертывания крови, защищающий организм от ее потери, основан на превращениях белка – фибриногена. Кератин – белок волосяного защитного покрова.
7. Фоторецепторные белки: например, родопсин, участвующий в зрительных процессах.
8. Резервные белки используются, как запасной материал для питания развивающегося зародыша и новорожденного организма – это белки семян зернобобовых культур, альбумин – яичный белок, казеин молока. Ферретин – белок животных тканей в котором запасено железо. Резервные белки являются важнейшими компонентами растительной и животной пищи.
