Белки и нуклеиновые кислоты
Имеется много других белков, функции которых довольно необычны. Например, монеллин – белок, выделенный из африканского растения, имеет очень сладкий вкус. Его изучают как вещество нетоксичное и не способствующее ожирению, с целью использования в пищу вместо сахара. Плазма крови некоторых антарктических рыб содержи белок, обладающий свойствами антифриза.
Технология многих производств основана на переработке белков, изменении их свойств; в кожевенной промышленности, при выделке мехов, натурального шелка, выработке сыров, хлеба и т.д.
1.8 Строение белковой молекулы
Для описания строения белковой молекулы были введены понятия о первичной, вторичной, третичной и четвертичной структурах белковой молекулы. В последние годы появились еще такие понятия, как сверхвторичная структура, характеризующая энергетически предпочтительные агрегаты вторичной структуры, и домены – части белковой глобулы, представляющие собой достаточно обособленные глобулярные области.
Количество и последовательность расположения аминокислот, и местоположение дисульфидных связей в полипептидной цепи определяют первичную структуру белка. Между первичной структурой белка и его функцией у данного организма существует самая тесная связь. Для того, чтобы белок выполнял свойственную ему функцию, необходима совершенно определенная последовательность аминокислот в полипептидной цепи этого белка. Даже небольшие изменения в первичной структуре могут значительно изменять свойства белка и соответственно его функции. Например, в эритроцитах здоровых людей содержится белок– гемоглобин с определенной последовательностью аминокислот. Небольшая часть людей имеет врожденную аномалию структуры гемоглобина: их эритроциты содержат гемоглобин, у которого в одном положении вместо глутаминовой кислоты (заряженной, полярной) содержится аминокислота валин (гидрофобная, неполярная). Такой гемоглобин существенно отличается по физико-химическим и биологическим свойствам от нормального. Появление гидрофобной аминокислоты, приводит к возникновению «липкого» гидрофобного контакта (эритроциты плохо передвигаются в кровеносных сосудах), к изменению формы эритроцита (из двояковогнутого в серповидный), а также к ухудшению переноса кислорода и т.д. Дети, родившееся с этой аномалией, в раннем детстве погибают от серповидноклеточной анемии.
Исчерпывающие доказательства в пользу утверждения, что биологическая активность определяется аминокислотной последовательностью, были получены, после искусственного синтеза фермента рибонуклеазы (Меррифилд). Синтезированный полипептид с той же аминокислотной последовательностью, что и естественный фермент, обладал такой же ферментативной активностью.
Исследования последних десятилетий показали, что первичная структура закреплена генетически и в свою очередь определяет вторичную, третичную и четвертичную структуры белковой молекулы и ее общую конформацию. Первым белком, у которого была установлена первичная структура, был белковый гормон инсулин (содержит 51 аминокислоту). Это было сделано в 1953 г. Фредериком Сэнгером. К настоящему времени расшифрована первичная структура более десяти тысяч белков, но это очень небольшое количество, если учесть, что в природе белков около 1012.
Зная первичную структуру белка, можно точно написать его структурную формулу, если белок представлен одной полипептидной цепью. Если в состав белка входит несколько полипептидных цепей, то их предварительно разъединяют, используя специальные реактивы. Для определения первичной структуры отдельной полипептидной цепи, методами гидролиза с использованием аминокислотных анализаторов, устанавливают ее аминокислотный состав. Затем, применяя специальные методы и реагенты, определяют природу концевых аминокислот. Для установления порядка чередования аминокислот, полипептидную цепь подвергают ферментативному гидролизу, при котором образуются осколки этой полипептидной цепи – короткие пептиды. Эти пептиды разделяют методом хроматографии и устанавливают последовательность аминокислот в каждом. Таким образом, достигается этап, когда последовательность аминокислот в отдельных пептидах (фрагментах белка) известна, но остается невыясненной последовательность самих пептидов. Последнюю устанавливают с помощью так называемых перекрывающихся пептидов. Для этого используются какой-либо другой фермент, расщепляющий исходную полипептидную цепь в других участках, и определяют аминокислотную последовательность вновь полученных пептидов. Пептиды, образованные под действием двух ферментов, содержат одинаковые фрагменты аминокислотных последовательностей., совмещая их устанавливают общую аминокислотную последовательность полипептидной цепи.
Большой вклад в изучение строения белковой молекулы сделали Л. Полинг и Р. Кори. Обратив внимание на то, что в молекуле белка больше всего пептидных связей, они первыми провели кропотливые рентгеноструктурные исследования этой связи. Изучили длины связей, углы под которыми располагаются атомы, направление расположения атомов относительно связи. На основании исследований были установлены следующие основные характеристики пептидной связи.
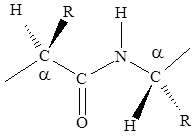
1. Четыре атома пептидной связи и два присоединенных a-углеродных атома лежат в одной плоскости. Группы R и Н a-углеродных атомов лежат вне этой плоскости.
2. Атомы О и Н пептидной связи и два a-углеродных атома и R-группы имеют транс-ориентацию относительно пептидной связи.
3. Длина связи С-N, равная 1,32 Е, имеет промежуточное значение между длиной двойной ковалентной связи (1,21 Е) и однородной ковалентной связи (1,47 Е). Отсюда следует, что связь С-N имеет частично характер двойной связи. Т.е. пептидная связь может существовать в виде резонансных и таутамерных структур, в кето-енольной форме.
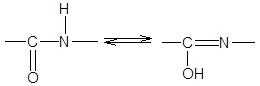
Вращение вокруг связи –С=N– затруднено и все атомы, входящие в пептидную группу, имеют планарную транс-конфигурацию. Цис-конфигурация является энергетически менее выгодной и встречается лишь в некоторых циклических пептидах. Каждый планарный пептидный фрагмент содержит две связи с a-углеродными атомами, способными к вращению. Это связи Сa–N (угол вращения вокруг этой связи обозначается j) и связь Сa–С (угол вращения вокруг этой связи обозначается y).
Пептидная связь по своей химической природе является ковалентной и придает высокую прочность первичной структуре белковой молекулы. Являясь повторяющимся элементом полипептидной цепи и имея специфические особенности структуры, пептидная связь влияет не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи.
Вторичная структура белковой молекулы образуется в результате того или иного вида свободного вращения вокруг связей, соединяющих a-углеродные атомы в полипептидной цепи.
В природных полипептидных цепях обнаружены три основных типа структуры: a-спираль, складчатый лист и статистический клубок. Спиральная структура образуется если в цепи одинаковые углы поворотов (j) для всех связей Сa–N и углом поворота (y) для всех связей Сa–С и равны соответственно –48є и –57є. Наиболее часто встречается правозакрученная a-спираль. Эта структура очень стабильна, т.к. в ней почти или полностью отсутствуют стерические затруднения, особенно для R-групп боковых цепей аминокислот. R-группы аминокислот направлены наружу от центральной оси a-спирали. В a-спирали диполи =С=О и >N–Н соседних пептидных связей ориентированы оптимальным образом (почти коаксиальны) для дипольного взаимодействия, образуя вследствие этого обширную систему внутримолекулярных кооперативных водородных связей, стабилизирующих a-спираль. Шаг спирали (один полный виток) 5,4Е включает, 3,6 аминокислотных остатка.
