Белки и нуклеиновые кислоты

Рисунок 1 – Структура и параметры a-спирали белка
Спиральную структуру могут нарушить два фактора:
1) в наличие остатка пролина, циклическая структура которого вносит излом в пептидную цепь – нет группы –NН2, поэтому невозможно образования внутрицепочечной водородной связи;
2) если в полипептидной цепи подряд расположено много остатков аминокислот, имеющих положительный заряд (лизин, аргинин) или отрицательный заряд (глутаминовой, аспарагиновой кислот), в этом случае сильное взаимное отталкивание одноименнозаряженных групп (–СОО– или –NН3+) значительно превосходит стабилизирующее влияние водородных связей в a-спирали.
Структура типа складчатого листа также стабилизирована водородными связями между теми же диполями =NН О=С<. Однако в этом случае возникает совершенно иная структура, при которой остов полипептидной цепи вытянут таким образом, что имеет зигзагообразную структуру. Углы вращения для связей Сa-N(j) и Сa-С (y) близки соответственно к –120+1350. Складчатые участки полипептидной цепи проявляют кооперативные свойства, т.е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные
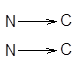
одинаковонаправленные полипептидные цепи или антипараллельные,
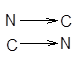
которые укрепляются благодаря водородным связям между этими цепями. Такие структуры называются b-складчатые листы (рисунок 2).
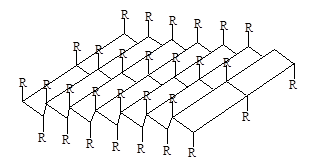
Рисунок 2 – b-структура полипептидных цепей
a-Спиральные складчатые листы – это упорядоченные структуры, в них имеется регулярная укладка аминокислотных остатков в пространстве. Участки белковой цепи с нерегулярной укладкой аминокислотных остатков в пространстве, которые также удерживаются благодаря водородным связям – называются неупорядоченными, бесструктурными – статистическим клубком. Все эти структуры возникают самопроизвольно и автоматически вследствие того, что данный полипептид имеет определенную аминокислотную последовательность, которая предопределена генетически. a-спирали и b-структуры обуславливают определенную способность белков к выполнению специфических биологических функций. Так, a-спиральная структура (a-кератин) хорошо приспособлена к тому, чтобы образовывать наружные защитные структуры-перья, волосы, рога, копыта. b-структура способствует образованию гибких и нерастяжимых нитей шелка и паутины, а конформация белка коллагена обеспечивает высокую прочность на разрыв, необходимую для сухожилий. Наличие только a-спиралей или b-структур характерно для нитевидных-фибрилярных белков. В составе глобулярных-шаровидных белков содержание a-спиралей и b-структур и бесструктурных участков сильно варьирует. Например: инсулин спирализован-на 60%, фермент рибонуклеаза – 57%, белок куриного яйца лизоцим – на 40%.
Сведения о чередовании аминокислотных остатков в полипептидной цепи, а также о наличии в белковой молекуле спирализованных, складчатых и неупорядоченных участков еще не дают полного представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу.
Эти особенности строения белка выясняются при изучении его третичной структуры, под которой понимают общее расположение в пространстве в определенном объеме полипептидной цепи.
Третичная структура устанавливается с помощью рентгеноструктурного анализа. Первая модель молекулы белка – миоглобина, отражающая его третичную структуру, была создана Дж. Кендрю с сотрудниками в 1957г. Несмотря на большие трудности к настоящему времени удалось установить третичную структуру более 1000 белков, в том числе гемоглобина, пепсина, лизоцима, инсулина и т.д.
Третичная структура белков образуется путем дополнительного складывания пептидной цепи содержащей a-спираль, b-структуры и участки без периодической структуры. Третичная структура белка формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот группируются внутри белковой молекулы, в то время как полярные радикалы ориентируются в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы – глобула. В такой форме белковая молекула характеризуется минимальной свободной энергией. На конформацию возникшей глобулы оказывают влияние такие факторы как рН раствора, ионная сила раствора, а также взаимодействие белковых молекул с другими веществами.
В последнее время появились доказательства, что процесс формирования третичной структуры не является автоматическим, а регулируется и контролируется специальными молекулярными механизмами. В этом процессе задействованы специфические белки – шапероны. Основными функциями их являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы.
Стабилизация третичной структуры обеспечивается благодаря нековалентным взаимодействиям между атомными группировками боковых радикалов следующих типов:
- водородные связи могут возникать между функциональными группами боковых радикалов. Например, между ОН группой тирозина и –N< в кольце остатка гистидина.
- электростатические силы притяжения между радикалами, несущими противоположно заряженные ионные группы (ион-ионные взаимодействия), например отрицательно заряженная карбоксильная группа (– СОО– ) аспарагиновой кислоты и (NН3+) положительно заряженной e-аминогруппой остатка лизина.
- гидрофобные взаимодействия обусловлены силами Ван-дер-Ваальса между неполярными радикалами аминокислот. (Например, группами –СН3 – аланина.
Стабилизируется третичная структура и ковалентной дисульфидной связью (–S–S–) между остатками цистеина. Эта связь очень прочная и присутствует не во всех белках. Важную роль эта связь играет в белковых веществах зерна и муки, т.к. оказывает влияние на качество клейковины, структурно-механические свойства теста и соответственно на качество готовой продукции – хлеба и т.д.
Белковая глобула не является абсолютно жесткой структурой: в известных приделах возможны обратимые перемещения частей пептидной цепи относительно друг друга с разрывом небольшого количества слабых связей и образования новых. Молекула как бы дышит, пульсирует в разных своих частях. Эти пульсации не нарушают основного плана конформации молекулы, подобно тому, как тепловые колебания атомов в кристалле не изменяют структуру кристалла, если температура не настолько велика, что наступает плавление.
