Бионеорганическая химия
Транспорт железа от ферритина к красным кровяным тельцам происходит с помощью белка трансферрина, очень прочно связывающего Fe (III) в хелат. Установлено, что хелаты Fe(III), образованные белками типа трансферрина, переносят железо через биомембраны, тогда как сам по себе фосфат железа, содержащийся в ферритине и гемосидерине, преодолеть этих преград не может.
Транспорт О2 в организме животных и человека осуществляется железосодержащими комплексами - гемоглобином и миоглобином. Оба этих белка содержат «гем-группы», представляющие собой порфириновый комплекс железа:
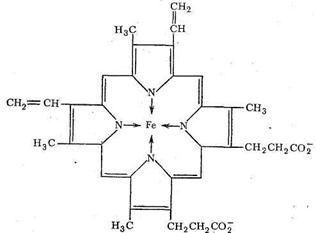
Гемовая группа присоединяется к белковой части молекулы гемоглобина и миоглобина путем координации гистидинового атома азота белка ионом железа гемовой группы. Таким образом, в координационную сферу иона железа входит пять атомов азота (четыре атома азота порфирина, один атом азота белкового гистидина). Шестое координационное место занимает Н2О или О2.
Гемоглобин имеет молекулярную массу 64 500 и включает четыре гем-группы. Миоглобин сходен с гемоглобином по строению, но содержит только одну гем-группу. Гемоглобин почти так же хорошо, как миоглобин, связывает кислород при высоком давлении кислорода, но, когда давление кислорода падает, преимущество в связывании О2 имеет миоглобин. Падение давления О2 наблюдается в тканях мышц, потребляющих кислород. Результатом использования кислорода является накопление в мышцах СО2 и, как следствие, понижение рН. Это еще более способствует высвобождению О2 из гемоглобина и передаче кислорода миоглобину. Таким образом, и гемоглобин, и миоглобин участвуют в переносе кислорода.
Теряя кислород, железо в гемоглобине (форма дезоксигемоглобина, КЧ железа = 5) переходит в высокоспиновое состояние. Ослабление связи с атомами азота порфирина приводит к выходу атома железа из плоскости кольца порфирина (на 0,7-0,8Ǻ). Напротив, вследствие присоединения кислорода к гемоглобину образуется низкоспиновый октаэдрический комплекс, железо в котором находится в плоскости порфиринового кольца (КЧ железа = 6). Хотя связывание молекулярного кислорода гемоглобином и миоглобином сопровождается ослаблением связи O = O в молекулярном кислороде из-за размещения π-дативных электронов железа на разрыхляющих орбиталях О2, этот процесс сам по себе не сопряжен с необратимым переносом электрона, поэтому его обычно не причисляют к ферментативным окислительно-восстановительным реакциям. Отметим, однако, что разрыхление связи O = O в не может не активировать окислительные реакции.
Например, можно рассматривать взаимодействие активированной формы О2 с восстановленной формой субстрата StH2, сопровождающееся переходом его в окисленную (дегидрированную) форму St:
|
|
При этом кислород превращается в Н2О и Н2О2 с выделением энергии.
Металлсодержащие ферменты
Далеко не все ферменты, катализирующие биологически важные процессы в организме животных и растений, содержат ионы металлов. Однако металлсодержащих ферментов только в организме человека несколько сотен, и их биологическая роль чрезвычайно важна. Нарушение структуры или удаление из организма даже одного из них приводит к тяжелым расстройствам функций организма, а затем и к его гибели.
Металлсодержащие ферменты представляют собой координационные соединения, и поэтому их исследованием занимается неорганическая химия или, точнее, координационная химия.
Рассмотрим строение и биологическую роль нескольких металлоферментов.
Каждый фермент состоит из двух частей: кофермента и апофермента. Кофермент - это легко отделяемая часть фермента. В металлоферментах ион металла составляет основную часть кофермента. Апофермент-остальная часть фермента, которая в отсутствие кофермента не проявляет ферментативной активности.
Обычно рассматривают две группы металлоферментов, различающихся по типу катализируемых ими реакций: ферменты, катализирующие реакции гидролиза, и ферменты, катализирующие протекание окислительно-восстановительных реакций.
Ферментативный катализ реакций гидролиза
Реакции, протекающие в организмах животных и растений с участием воды, играют важнейшую роль в процессе обмена веществ и служат одним из основных источников "энергии, запасаемой организмом.
Реакции гидролиза катализируются обычно теми металлоферментами, которые содержат ионы Са2+, Mg2+, Zn2+ и Мn2+. Хотя ион Мn2+ легко вступает в окислительно-восстановительные реакции, в ходе гидролитических реакций он, как и все упомянутые ионы, не меняет степени окисления.
Наиболее хорошо изучены строение и биологическая роль двух из металлоферментов, катализирующих гидролитические процессы, - цинксодержащих ферментов карбоангидразы и карбоксилазы. Отметим, однако, что только в организме человека содержится несколько десятков цинксодержащих ферментов, различающихся по своему строению и функциям.
Карбоангидраза состоит из больших белковых молекул с молекулярной массой 430 000. Каждая из таких макромолекул содержит 260 аминокислотных остатков. Форма молекулы карбоангидразы - эллиптическая, размеры ее (40x45x55) А3. Эллиптическая молекула карбоангидразы имеет полость, причем аминокислоты, составляющие белок апофермента, расположены так, что гидрофобные их части как бы выстилают внутреннюю полость макромолекулы. В одной молекуле фермента содержится только один ион Zn2+, который находится вблизи центра полости карбоангидразы. Координационный полиэдр комплекса, центральным ионом которого является Zn2+, представляет собой искаженный тетраэдр. Три положения в координационной сфере Zn2+ занимают донорные атомы азота из имидазольных групп аминокислоты гистидина:
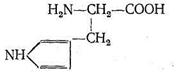
Четвертое координационное место занято молекулой Н2О или ионом ОН-. Фермент карбоангидраза содержится в красных кровяных тельцах. Установлено, что карбоангидраза примерно в 106 раз ускоряет реакцию образования бикарбонат-иона и обратную ей реакцию распада НСО3-:
![]()
Рассмотрим предполагаемый «концертный» механизм действия карбоангидразы. Ион Zn2+, входя в состав несимметрично построенного координационного соединения (имеющего по этой причине напряженную структуру), обладает высокой реакционной способностью. Столкновение на активном центре карбоангидразы иона Zn2+, СО2 и иона ОН - в полости карбоангидразы приводит к активации всех участвующих в реакции веществ, в результате чего быстро образуется бикарбонат цинка:
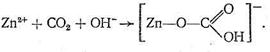
Следующий этап процесса состоит в обмене образовавшегося бикарбонат-иона на Н2О или ОН-, т. е. в высвобождении активного центра фермента для последующих актов катализа.
Установлено, что ингибирование реакции синтеза и распада бикарбонат-ионов достигается введением в координационную сферу иона Zn2+ лигандов, образующих более прочную связь с Zn2+, чем с НСО3-,Н2О или ОН-. Такими являются ионы CN-, N3-, S2O42 - и др. Так как в некатализируемых условиях (в присутствии CN-, N3 - и т. д.) синтез НСО3 - и его распад протекают слишком медленно, физиологические требования не выполняются, нормальное состояние организма нарушается.
