Бионеорганическая химия
Каталитическая активность карбоангидразы не понижается при замене Zn2+ на ион Со2+, в других случаях активность фермента либо падает, либо исчезает.
Карбоксипептидаза представляет собой фермент, вырабатываемый поджелудочной железой млекопитающих. Так же как карбоангидраза, этот фермент содержит один ион Zn2+ на одну белковую макромолекулу, молекулярная масса которой 34300. Биологическая роль карбо-ксипептидазы заключается в катализе процесса гидролиза пептидов - разрыве пептидной связи на карбоксильном конце пептидной цепи:
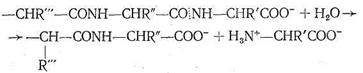
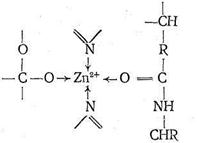
Ион Zn2+ в карбоксипептидазе, так же как в карбоангидразе, находится в полости активного центра фермента, но только два места в его координационной сфере заняты азотом имидазольных остатков гистидина. Третье место занято кислородом другой аминокислоты - глутамина. Четвертое координационное место в координационной сфере Zn2+ принадлежит молекуле воды. Таким образом, и в этом ферменте координационная сфера Zn2+ несимметрична, что, по-видимому, обусловливает напряженность структуры фермента и является обязательным условием каталитической активности комплексных соединений.
|
|
Предполагают, что одной из важных стадий каталитического процесса, протекающего с участием карбоксипептидазы, является координация ионом Zn2+ атома кислорода карбонила пептидной цепи с вытеснением Н2О, занимающей одно место в координационной сфере. Координация цинком карбонильного кислорода ослабляет связь С-N в пептидной цепи, что облегчает ее разрыв, сопровождающийся гидролизом. Гидролиз разорванной цепи приводит к ослаблению координации карбонильного кислорода пептидной цепи ионом Zn2+. Происходит вытеснение молекулой Н2О, затем вновь следует координация ионом Zn2+ карбонильного кислорода неразорванной цепи и т, д, Ферментативная активность карбоксипептидазы сохраняется, если Zn2+ заменить на ион Со2+, так же как в случае карбоангидразы. По-видимому, это связано с очень близкими величинами констант устойчивости (т. е. сходными термодинамическими, характеристиками) аналогичных комплексов Zn2+ и Со2+, а также одинаковыми размерами этих ионов. Замена Zn2+ в карбоксипептидазе на Gd2+, Hg2+, Cu2+, Pb2+ приводит к исчезновению каталитической активности фермента.
К группе ферментов, катализирующих процессы гидролиза, относятся также киназы, ускоряющие перемещение различных фрагментов биолигандов (например, ионы РО3-)от одного биополимера к другому. Все киназы содержат ионы М2+. Аминопептидазы (ионы Mg2+, Zn2+, Mn2+, Ca2+-кофермент) катализируют гидролиз пептидов, при этом каждый из большого числа ферментов, входящих в эту группу, ускоряет разрыв пептидной связи именно для данного сочетания разноименных аминокислот в пептидной цепи. Фосфатазы катализируют гидролиз сложных эфиров на основе ортофосфорной кислоты.
Ферментативный катализ окислительно-восстановительных реакций
Окислительные реакции, протекающие в живом организме с участием молекулярного кислорода, вносят основной вклад в накопление организмом энергии. Окислительно-восстановительные реакции в отсутствие катализатора всегда протекают медленнее, чем реакции обмена ионов (тоже не катализируемые), например реакции гидролиза. Поэтому роль ферментативного катализа в ускорении окислительно-восстановительных процессов, протекающих в живых организмах, является особенно важной. Окислительно-восстановительные реакции в организме катализируются ферментами, содержащими ионы цинка, железа, меди, молибдена, кобальта. Роль металлсодержащих групп в ферментах, катализирующих окислительно-восстановительные процессы, изучена недостаточно. Однако ясно, что ион металла в ферменте не всегда входит в активный его центр. В ряде случаев ионы металла определяют лишь третичную и четвертичную структуру белка, образующего апофермент, а сам по себе кофермент ионов металла не содержит. Тем не менее роль металла остается крайне важной - замена ионов одного металла на другой меняет структуру фермента и его активность.
Из металлсодержащих ферментов, катализирующих окислительно-восстановительные процессы, наиболее изучены цинксодержащие дегидрогеназы, а также железосодержащие ферменты.
К числу ферментов, катализирующих окислительно-восстановительные реакции, относятся гемсодержащие ферменты - цитохромы. Атомы железа в цитохромах, так же как в гемоглобине и миоглобине, координируют пять атомов азота (порфирина и гистидина), шестое координационное место занимает атом серы аминокислоты - метионина. Известно 50 видов ферментов этого типа, несколько различающихся по составу органической его части. Железо в цитохромах играет роль переносчика электронов - оно принимает электроны от восстановителя и передает их окислителю. Окислителем может быть и кислород, но он не участвует в координации железа, входящего в состав цитохромов, поскольку железо в цитохроме имеет полностью насыщенную координационную сферу.
Среди гемсодержащих ферментов, катализирующих окислительно-восстановительные реакции, также большое значение имеют гем-белки - каталаза и пероксидаза, ускоряющие распад перекиси водорода. Последняя образуется в результате катализируемого ферментами взаимодействия восстановленных форм субстратов с молекулярным кислородом.
Кроме гемсодержащих ферментов известно большое число металлсодержащих ферментов, имеющих «негемовое» строение. К их числу принадлежат ферредоксины, играющие в живых организмах, подобно цитохромам, роль переносчиков электронов. Ферредоксины имеют молекулярную массу от 6000 до 12 000. Атомы железа в них окружены четырьмя атомами серы:
![]()
Концевые атомы серы принадлежат цистеиновому фрагменту белка. Считают, что важную роль источника (или «ловушки») электронов играет группировка Fe4S4, содержащаяся в каждом из ферредоксиновых белков.
Окислительно-восстановительные реакции катализируются также металлоферментами, включающими медь и другие металлы. Важное значение имеет оксидаза аскорбиновой кислоты, содержащаяся в растениях и микроорганизмах. Молекулярная масса оксидазы 140 000, на одну такую белковую глобулу приходится восемь атомов меди. Как показывает название, оксидаза катализирует переход аскорбиновой кислоты в дегидроаскорбиновую кислоту. Медь также содержится в белке-гемоцианине, который способен связывать молекулярный кислород (О2 на два атома меди). Используется гемоцианин для транспорта кислорода в организмах низших животных.
К числу ферментов, катализирующих перенос электронов, т. е, окислительно-восстановительные процессы, относится нитрогеназа, содержащаяся в азотистых бактериях. Нитрогеназа катализирует связывание атмосферного азота. С использованием меченого азота (15N2) показано, что бактерии восстанавливают N2 в первую очередь до аммиака. Этот процесс происходит только в присутствии Mo, Fe и Mg. Установлено, что нитрогеназа состоит из двух белков (молекулярная масса 250 000 и 70 000), каждый из которых по отдельности не активен.