Зависимость изменения скорости протекания электролиза от концентрации электролита
Таблица 1.
5. Напряжение разложения электролита.
При наложении на электроды внешнего тока равновесие электродных реакций [Ох]+nе < > [Red] нарушается. На электроде, присоединенном к отрицательному полюсу источника тока, оно сместится вправо, а потенциал — до значения, при котором скорость реакции восстановления окислителя будет превосходить скорость обратной реакции на величину внешнего тока. На электроде, присоединенном к положительному полюсу источника тока, будут происходить аналогичные электродные процессы, но противоположно направленные. В результате смещения потенциалов в электролизере возникает э. д. с, равная напряжению, приложенному извне, и противоположная по направлению. Однако, как показывает опыт, ток заметной величины начинает проходить через электролитическую ячейку лишь при достижении напряжения на электролизере до определенной величины. Зависимость силы тока от приложенного напряжения при электролизе показана на графике (рис. 2). На кривой виден излом. Продолжение прямого участка кривой до пересечения с ось абсцисс отсекает на ней отрезок, равный минимальному напряжению, необходимому для разложения электролита инертных электродах, при котором происходит электролиз с заметной скоростью. Это минимальное напряжение называют напряжением (э.д.с.) разложения электролита.
Равновесные потенциалы электродных реакций, протекающих при электролизе, рассчитывают по формуле Нернста. Для этого в таблице стандартных электродных потенциалов находят значения потенциалов реакций, подставляют в формулу концентрации веществ, участвующих в электродных реакциях и решают уравнение с одним неизвестным. Разность найденных по формуле Нернста равновесных потенциалов катода и анода равна э. д. с, при которой скорости прямых и обратных реакций на электродах равны. Следовательно, при найденном значении э. д. с. ток в цепи равен нулю. Электролиз будет протекать лишь при напряжении, превосходящем разность равновесных потенциалов электродных реакций. Только при таком условии возможно прохождение тока. Например, при электролизе воды катод можно рассматривать как водородный, а анод как кислородный электроды. Э. д. с. такой пары электродов при отсутствии тока в цепи и рН—7 равна 1,23 в.
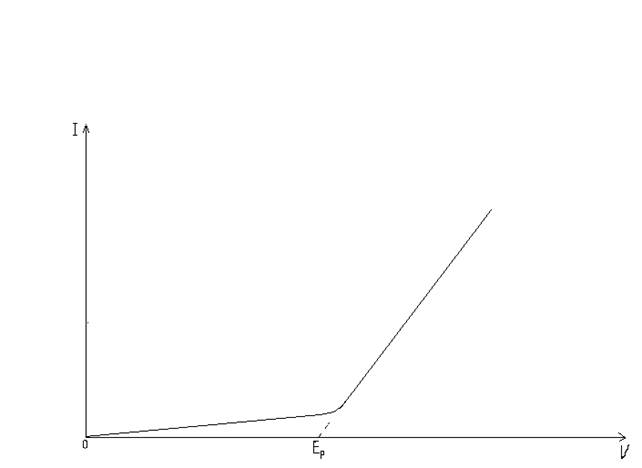 Рис. 2. График зависимости силы тока от напряжения при электролизе.
Рис. 2. График зависимости силы тока от напряжения при электролизе.
При получении кислорода и водорода электролизом, раствора серной кислоты на платиновых электродах требуется напряжение на 0,5 в большее, чем 1,23 в, а именно не менее 1,7 в. Эта часть напряжения необходима для преодоления сопротивления протеканию тока, связанного с перенапряжением (затруднением) электрохимических реакций, и сопротивления электролита.
V=фа - фк +na +nk + фраств
Где V – напряжение на электродах ванны;
фа и фк – потенциалы катода и анода, рассчитанные по формуле Нернста,
с учетом изменения концентрации веществ при электролизе;
фраств – падение напряжения на сопротивлении раствора
na и nk – перенапряжение анодной и катодной реакций.
При этом часть электродной энергии превращается в химическую, а часть – в тепловую.
A = n*F*v = n*F*(фа - фк +na +nk + фраств ) = An + Ah + Aраств
Где n*F – число Фарадеев электричества, необходимое для восстановления
на катоде и окисления на аноде 1 моля вещества.
An - Полезная работа (An = n*F*(фа - фк));
Aраств - теплота освобождающаяся на сопротивление электролита
(Араств = n*F*фраств);
Ah - теплота освобождающаяся на сопротивление перенапряжения
(Ап = n*F*(na +nk));
Из этих уравнений следует, что перенапряжение электродных реакций и сопротивление раствора снижают к. п. д. электролитической ванны.
Напряжение разложения электролита равно разности между напряжением, подаваемым на ванну, и падением напряжения на сопротивлении раствора. Оно складывается из равновесных электродных потенциалов и соответствующих перенапряжений катодной и анодной реакций:
Ep = v - фраств = фа - фк +na +nk
Напряжение разложения зависит как от природы электролита, так и от природы электродов.
6. Поляризация электродов.
При электролизе потенциалы электродов смещаются в противоположные стороны до значений, при которых становится возможным протекание катодной и анодной реакций. Это явление носит название поляризации. Электроды при электролизе поляризуются в следствии следующих причин:
1) изменения химической природы поверхности электродов при накоплении на них продуктов электролиза (химическая поляризация);
2) замедленности стадии разряда (ионизации) участвующих в реакции веществ при последующих неэлектрохимических стадий (перенапряжение);
3) медленного подвода (отвода) к электроду веществ, участвующих в электродном процессе, по сравнению со скоростью самой реакции (концентрационная или диффузионная поляризация).
Химическая поляризация электродов наблюдается в тех случаях, когда на них адсорбируют или отлагаются продукты окисления-восстановления. Так, например, на платиновом катоде при электролизе воды адсорбируется водород и катод из платинового как бы превращается в водородный, для которого характерна электродная реакция 2Н+ + 2е « Н2 и соответствующее значение потенциала. При выделении хлора на платиновом электроде платиновый электрод превращается в хлорный. Точно так же при гальваническом покрытии меди никелем медный электрод превращается в никелевый, и потенциал смещается в отрицательную сторону до значения, соответствующего никелевому электроду.
В ряде случаев прохождению электрического тока препятствует замедленность перехода электронов с катода на восстанавливающиеся частицы или с частиц восстановителя на анод. Для того чтобы электролиз протекал с достаточно высокой скоростью, потенциал катода должен быть смещен от равновесного значения в отрицательную сторону, а потенциал анода соответственно в положительную. Затрудненной может оказаться и какая – либо другая стадия электродной реакции, например десорбция газообразных продуктов электролиза, образование новой фазы на поверхности электрода (кристаллов металла или пузырьков газа), соединение атомов в молекулы, адсорбция разряжающихся ионов и.т.д.
Перенапряжение электродных реакций можно вычислить по разности между напряжением разложения и э.д.с. химической поляризации:
na + nk = Ер - фа + фк
Оно зависит от плотности тока, проходящего через электроды, и эта зависимость выражается уравнением Тафеля:
nk = a + b * lg ik
na = a, + b, * lg ia
где ia и ik – плотность тока на аноде и соответственно на катоде, а/ см2
a(a’) и b(b’) – константы.
При повышении температуры на 10 С перенапряжение уменьшается на
2-3 мв. Оно также зависит от природы вещества, из которого изготовлен электрод. Например, при выделении водорода из соляной кислоты на катоде из платины при плотности тока 1 А/см2 требуется напряжение всего 0,1 в, в то время как на катоде из свинца – 1,5 в, а из ртути – 1,4 в.
