Зависимость изменения скорости протекания электролиза от концентрации электролита
При напряжении, достигающем напряжение разложения воды, электролизу подвергается и вода. В этом случае также происходит разделение зарядов в ванне с загущенным электролитом. Катодное пространство при длительном электролизе зарядится отрицательно, а анодное – положительно.
8. Кулонометрия.
По количеству выделившегося при электролизе вещества можно установить суммарное количество электричества. И наоборот, по количеству протекшего электричества представляется возможным определить содержание веществ в растворе, толщину гальванических покрытий, окислых пленок и др. Если принять во внимание, что потенциалы большинства электродных реакций известны, то по величине потенциала, при котором протекает та или иная реакция, определяют также, какие вещества содержатся в растворе (качественный анализ). Из электрохимических методов анализа в настоящее время применяют полярографию, потенциометрию и кулонометрию.
Метод количественного анализа, основанный на законе Фарадея, называется кулонометрией.
Кулонометры.
Приборы, применяемые для измерения количества электричества, называют кулонометрами. Широко применяются весовые (серебряный, медный) и объемные (ртутный, газовый) кулонометры. В серебряном кулонометре (рис. 3) анод делают из платины или серебра. Диафрагмой служит пористый сосуд, препятствующий попаданию кислорода на катод. В кулонометр наливают слегка подкисленный раствор азотнокислого серебра. Процесс ведут при катодной плотности тока, не превышающей 0,02 А/см2, и анодной плотности тока не более 0,2 А/см2. По увеличению веса катода определяют количество восстановившегося серебра и рассчитывают количество электричества, прошедшего через раствор. Серебряный кулонометр наиболее точный. Ошибка составляет не более 0,005 процента.
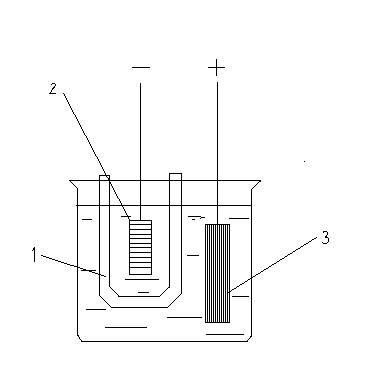
Рис. 3 Весовой кулонометр.
1 – пористый сосуд. 2 – катод.
3 – анод.
В медном кулонометре катод и анод изготавливают из меди. Раствор содержит 50 г/л серной кислоты (уд. в. 1,84), 150 г/л медного купороса и 50 г/л сахара. Сахар необходим для предотвращения реакции, происходящей в электролите:
Сu+ ® Cu2+ +Cu¯
Процесс ведут при плотности тока в электродах 0,002 – 0,02 А/см2. Медный кулонометр не обеспечивает высокой точности (ошибка ~0,2 процента), так как в электродах образуются ионы Cu+ и на катоде восстанавливается кислород, попадающий в раствор из воздуха.
В ртутном кулонометре анодом служит ртуть, катодом – графит, электролитом – раствор, содержащий 225 г/л йодистой ртути и750 г/л йодистого калия. При электролизе металл анода окисляется и переходит в раствор в виде ионов Hg2+. На катоде происходит их восстановление и накапливается металлическая ртуть, которая стекает в градуированную (в кулонах) трубку. Ртутный кулонометр дает большую ошибку (около 1 процента), но удобен при измерении больших количеств вещества и позволяет работать с большими плотностями тока (I < 0.1 А/см2).
В газовом кулонометре электродами служат никелевые пластинки. Электровводы, проходящие через стеклянную стенку кулонометра внутрь ячейки, делают из молибденовой проволоки, которая хорошо впаивается в стекло. Электролитом служит 15-процентный раствор сернокислого натрия или 20-процентный раствор едкого натра. Электролиз ведут при катодной плотности тока не выше 0,04 А/см2. Количество электричества рассчитывают по объёму водорода и кислорода в эвдиометре. Подставив значение g из уравнения Менделеева – Клапейрона в уравнение
g=N*э = (э*I*t)/F, получим
Q = I*t = (g*F)/э = (P*v*M)/R*T * (F/э) * 2/3 =
= 2.064074*(P –PH2O)*v/T (k)
В этом уравнении расчет ведется на водород. Поэтому в уравнении введен коэффициент 2/3, так как водород составляет 2/3 от объёма газовой смеси.
По количеству электричества, пошедшего через кулонометр (Qk), включенного последовательно в цепь с электролизёром, можно определить выход по току (g), если известно количество вещества (g), выделившегося на катоде или аноде электролизера. Для этого из уравнения g=N*э = (э*I*t)/F рассчитывают количество электричества, пошедшего на данную электродную реакцию (Qэ).
Qэ = g*F/э.
И далее находят выход по току в процентах:
g = Qэ / Qk*100%
С помощью кулонометра по количеству электричества, которое необходимо для полного выделения вещества, для электродной реакции
Ох + ne®Red
или
Red - ne®Ox,
Можно определить концентрацию этого вещества в растворе (если известна n) или величину n (если известна концентрация).
При проведении кулонометрического анализа побочные электродные реакции в электролизёре, снижающие выход по току, должны быть исключены.
Так как окислительно-восстановительные потенциалы для большинства веществ известны, то побочных реакций можно избежать, если процесс вести при строго определенном потенциале, при котором другие вещества ещё не выделяются. Непременным условием аналитического определения является обнаружение конца реакции. Если реакция ведется при постоянном потенциале, то на её завершение указывает падение силы тока в цепи до нуля.
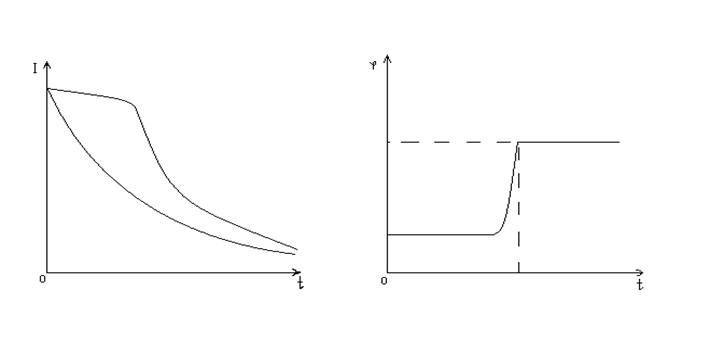
А Б
рис. 4 Графики зависимости силы тока и потенциала от времени:
а – изменение силы тока при постоянном потенциале.
б – изменение потенциала при постоянной силе тока.
Однако для достижения полного выделения вещества требуется много времени, так как сила тока во времени уменьшается плавно (рис. 4-а).
При постоянной силе тока на завершение реакции указывает резкое изменение потенциала, например при анодном растворении цинкового покрытия с железного изделия (рис. 4-б).
9. Кулонометрический анализ при постоянном потенциале.
Схема электрической цепи для кулонометрического анализа при постоянном потенциале приведена на рисунке 5. Для поддержания потенциала электрода необходимо чтобы сила тока проходящего через сопротивление r1и r2 была в 10 – 100 раз больше, чем в боковой цепи. Этого можно достигнуть, если сопротивление r1 будет в 10 – 100 раз меньше суммарного сопротивления в боковой цепи, что устанавливается в каждом случае опытным путем.
В качестве источника постоянного тока можно взять батарею аккумуляторов на 12 в или селеновые выпрямители, чтобы ёмкость источника тока была большой. Зарядный потенциал поддерживается с помощью сопротивлений R1 и R2 и контролируется потенциометром. Лучше пользоваться показывающим потенциометром ЛПУ – 01. Можно пользоваться также и другими потенциометрами с высокоомным входом. Электродом сравнения может служить насыщенный каломельный электрод fкалом = 0,243 в. В тех случаях, когда перенос продуктов анодной реакции на катод или продуктов катодной реакции на анод снижает выход по току и недопустим, электрод, по которому не ведут расчет, помещают в пористый сосуд или стеклянную трубку, со стеклянным фильтром, заполненным растворами сернокислого натрия, азотнокислого калия или серной кислоты.
