Исследование условий возникновения колебательного режима в процессе окислительного карбонилирования фенилацетилена
В реакции Белоусова - Жаботинского при взаимодействии ионов Ce4+ с малоновой кислотой происходит их восстановление:
Ce4 + + C3H3O4 → Ce3 + + продукт (1)
Образующийся в ходе реакции Ce3 + должен затем вступить в реакцию с бромат - ионом:
Ce3 + + HBrO3 → Ce4 + + продукт (2)
В результате происходит стационарное распределение церия между степенями окисления. Однако, реакция (2) относится к автокаталитическим, и в ней самоускоряющемуся протеканию предшествует период индукции, то есть реакция включается не сразу. Поэтому за время периода индукции практически все ионы Ce4+ переходят в Ce3+. При этом окраска раствора, обусловленная поглощением света в видимой области спектра комплексом Ce4+ с малоновой кислотой, исчезает. По завершении периода индукции происходит самоускоряющийся быстрый переход ионов Ce3+ в Ce4+ и раствор окрашивается вновь.
Периодический характер процесса (предполагается, что в исходной системе содержится некоторое количество Ce4+) можно объяснить следующим образом. В результате реакции (1) образуются бромид-ионы, замедляющие реакцию (2). Однако концентрация бромида в системе зависит от скорости реакции, в которой бромид расходуется за счет взаимодействия с броматом. Если концентрация бромида достаточно высока, то реакция (2) прекращается, так как Ce4 + не регенерируется при окислении Ce3+ броматом, и в результате каталитический цикл прерывается. Когда концентрация Ce4 +, уменьшающаяся в результате реакции (1), достигает минимально возможного значения, концентрация Br- начинает резко уменьшаться. Тогда реакция (2) заметно ускоряется и концентрация Ce4 + растет до некоторого значения, при котором концентрация бромида начинает быстро увеличиваться, замедляя тем самым реакцию (2). Затем весь цикл повторяется.
Механизм реакции весьма сложен с химической точки зрения и содержит десятки промежуточных стадий [13]. Выделим основные стадии, которые определяют колебательный характер реакции.
Это:
1) окисление трехвалентного церия броматом:
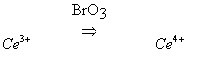
2) восстановление четырехвалентного церия малоновой кислотой (МК):
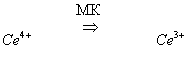
Продукты восстановления бромата, образующиеся на стадии 1, бромируют МК. Получающиеся бромопроизводные МК разрушаются с выделение Br-.
Когда реакция происходит в хорошо перемешиваемой среде, в некоторой области начальных концентраций наблюдаются колебания концентраций, которые имеют период порядка минуты и продолжаются около часа. Например, при взаимодействии Ce4+ с малоновой кислотой в присутствии бромат-иона раствор периодически окрашивается то в вишнево-красный цвет, то становится бесцветным. Такие химические часы будут тикать до тех пор, пока в системе есть бромат и малоновая кислота. Временная периодичность может быть переведена и в пространственную. Капля реактива, нанесенная на подложку из желатина или агар-агара, за счет диффузии рисует великолепные кольца, а две капли создают настоящую интерференционную картину. Постепенно колебания затухают, поскольку система замкнута и в нее не поступают исходные вещества, необходимые для протекания реакции. Если реакцию проводить в длинной трубке, в ней можно наблюдать возникновение горизонтальных зон, соответствующих чередующимся областям высоких концентраций. Наконец, если реакция протекает в тонком перемешиваемом слое, например, в чашке Петри, можно наблюдать различные типы волновой активности- это и концентрационные волны с цилиндрической симметрией, и вращающиеся спиральные волны.
2.1.3. Реакции Брея – Либавского и Бриггса-Раушера
Определенный интерес представляют гомогенные колебательные химические реакции с участием пероксида водорода - реакции Брея - Либавского и Бриггса - Раушера, основанные на проявлении двойственной роли H2O2 как окислителя и восстановителя.
В 1931 году Брей и Либавский и их сотрудники начали серию исследований по реакциям соединений иода с H2O2 [13]. Разложение пероксида водорода, катализируемое иодатом, включает в себя два процесса:
-окисление иода до иодноватой кислоты пероксидом водорода
5H2О2 + I2 = 2HIO3 + 4H2O
-восстановление иодноватой кислоты до иода пероксидом водорода
5H2O2 + 2HIO3 = I2 + 5O2 + 6H2О
Хотя эти реакции были впервые описаны Оже [13], только Брею в 1921 году удалось обнаружить в данной системе колебания, имеющие в условиях эксперимента затухающий характер. Реакция окисления иода до иодноватой кислоты пероксидом водорода - автокаталитическая и протекает с высокой скоростью; скорость реакции восстановления иодноватой кислоты до иода пероксидом водорода относительно невелика.
Система Брея - Либавского является первым известным гомогенным осциллятором и содержит мало компонентов.
Эти колебательные явления почти не привлекали внимания в течение последующих 15 лет. В 1951 году Перд и Каллис [13] подтвердили колебательное выделение О2 и измерили влияние каждого компонента на ее суммарную скорость. Они приписали колебания “очень необычному сочетанию химических и физических факторов”, включая улетучивание иода.
Шоу и Притчард [13] также наблюдали эти колебания, но утверждали, что для колебаний необходим свет, и оспаривали возможность существования гомогенных колебательных систем. Почти полвека продолжались попытки опровергнуть открытые Бреем периодические изменения в процессе взаимодействия иодат-пероксид водорода. Однако в 1967 году было подтверждено наличие колебаний в этой реакции и предложена математическая модель, описывающая колебания, подобные экспериментально наблюдаемым.
В конце 60-х годов Дегн, а также Дегн и Хиггинс [13] показали, что свет не является необходимым для возникновения колебаний; они также использовали Na2O2 и перегнанный H2O2 чтобы исключить влияние ингибиторов. Дегн считал, что, поскольку окисление I2 сильно подвержено влиянию галогенидов и ненасыщенных органических соединений, реакция, возможно идет по свободнорадикальному цепному механизму. На реакцию эти реагенты не влияли. Он отмечал также, что H2O2 ингибирует реакцию. Линдбладу и Дегну [13] удалось смоделировать колебательное поведение, используя гипотетическую схему реакций, включающую квадратичное размножение свободных радикалов. Однако ничего не было сказано по поводу химической природы переменных этой модели.
Шопен-Дюма [13] использовала проточный реактор постоянного перемешивания и регистрировала изменения потенциала с помощью электродной системы Pt |HgSO4| Hg. Она варьировала [H2SO4] и [KIO3] и температуру (50-950С), очертила границы колебательной области и определила типы переходов к неколебательному поведению. Ею были также найдены области колебаний сложной формы.
Вавилин и др. [13] использовали иод - серебряный электрод и спектрофотометр для одновременной записи [I–] и [I2]. Они также обнаружили область сложных колебаний. Шарма и Нойес представили данные, включая действие света и кислорода на эти колебания. Их статья 1976 года подводит итог проделанной работы и состояния знаний об этой системе на то время.
