Марганцево-цинковые элементы
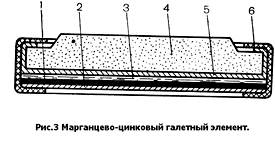 Галетные элементы используются практически только в составе батарей. Отдельные элементы стягиваются с помощью бандажа в столбы — секции. В галетных батареях объем исполь зован значительно лучше, чем в батареях из цилиндрических стаканчиковых элементов; поэтому и выше удельная энергия. Кроме того, в галетном элементе может быть использовано почти в 3 раза меньше цинка на единицу емкости, так как цинк здесь не является конструктивным элементом и может быть растворен «насквозь». В галетных батареях отпадает необходимость в межэлементных соединениях и в затрате на это латуни и припоя. Поэтому в настоящее время большинство марганцево-цинковых батарей выпускаются в галетной конструкции. Только низковольтные батареи большой емкости или рассчитанные на большие токи разряда (например, стандартная «плоская» батарея для карманных фонарей) изготавливаются из стаканчиковых элементов.
Галетные элементы используются практически только в составе батарей. Отдельные элементы стягиваются с помощью бандажа в столбы — секции. В галетных батареях объем исполь зован значительно лучше, чем в батареях из цилиндрических стаканчиковых элементов; поэтому и выше удельная энергия. Кроме того, в галетном элементе может быть использовано почти в 3 раза меньше цинка на единицу емкости, так как цинк здесь не является конструктивным элементом и может быть растворен «насквозь». В галетных батареях отпадает необходимость в межэлементных соединениях и в затрате на это латуни и припоя. Поэтому в настоящее время большинство марганцево-цинковых батарей выпускаются в галетной конструкции. Только низковольтные батареи большой емкости или рассчитанные на большие токи разряда (например, стандартная «плоская» батарея для карманных фонарей) изготавливаются из стаканчиковых элементов.
6) Модификации и разновидности двуокиси марганца
Двуокись марганца образует большое количество кристаллографических модификаций, обозначаемых буквами греческого алфавита. В природе встречаются α-МnО2 — криптомелан, β-МnО2 — пиролюзит и γ-МnО2— рамсделит. Некоторые модификации содержат посторонние катионы, например К+, Ва2+ (α- и γ-МnО2) или 4—6% структурной воды (α-, γ-, δ- и т]-МпО2). Стехиометрический состав выражается формулой МnОn где п колеблется от 1,9 до 2.
В элементах используются четыре разновидности двуокиси марганца. Природная руда. Наибольшее значение имеют месторождения пиролюзита. Обогащенная пиролюзитная руда содержит 85— 90 % β-МnО2 и является наиболее дешевым, но относительно малоактивным электродным материалом. Она почти не подвержена самопроизвольному разложению и обеспечивает хорошую сохраняемость элементов.
Активированный пиролюзит (ГАП) получают прокаливанием пиролюзита, в ходе которого на поверхности зерен МnО2 частично разлагается с образованием Мn3О4. При последующей обработке серной кислотой растворяются низшие окислы марганца и примеси и образуется высокопористая γ-МnО2. ГАП имеет более положительный (примерно на 0,15—0,2 В) начальный потенциал и более высокий коэффициент использования, чем исходный пиролюзит.
Электролитическую двуокись марганца (ЭДМ) получают анодным осаждением из растворов сульфата марганца на графитовых анодах. Она состоит из γ-МпО2 и отличается высокой степенью чистоты и высокой активностью. Из-за этого, а также из-за возможности использования в качестве исходного сырьябедных марганцевых руд ЭДМ находит все более широкое применение в элементной промышленности.
Искусственную двуокись марганца (ИДМ) получают химическим путем. В зависимости от способа приготовления образуются продукты с разными свойствами. Большое значение имеет сильно гидратированная ИДМ, получаемая термическим разложением перманганатов. Она представляет собой η-МnО2 и имеет довольно стабильный разрядный потенциал.
Удельная проводимость порошков МnО2, измеренная при давлении 100 МПа, колеблется для разных сортов от 0,1 до 5 См/м. Для повышения удельной электрической проводимости в активную массу добавляют природные чешуйчатые сорта графита («элементный графит») и (или) ацетиленовую сажу. Сажа играет также очень важную роль, повышая влагоемкость активной массы и удерживая запас электролита вблизи всех частиц электрода. Использование других сортов сажи или искусственного графита не дает нужных результатов. Содержание углеродистых добавок колеблется от 8 до 20 %. В элементы, предназначенные для разряда большими токами, вводят до 20 % графита. В элементы, рассчитанные на малые токи и на длительное хранение, вводят минимальное количество добавок.
в) Отрицательный электрод
В марганцево-цинковых элементах используется цинк с чистотой не менее 99,94 %, обладающий относительно высокой коррозионной стойкостью. Допускаются примеси, на которых скорость выделения водорода низка, например кадмия или свинца. Иногда используются специальные присадки свинца, которые улучшают структуру цинка и облегчают вытяжку стаканчиков.
г) Электролит
Основными компонентами электролита являются хлориды аммония (нашатырь) и цинка, а также загустители — мука или крахмал. Оба хлорида участвуют во вторичных реакциях и тем самым во многом определяют характер процесса разряда элементов. Повышение содержания NН4С1 в электролите увеличивает удельную электрическую проводимость, но одновременно снижается рН раствора, что ускоряет коррозию цинка. Поэтому сохраняемость элементов с повышенным содержанием NН4С1 ниже. ZnС12 сильно влияет на тиксотропные свойства электролитов, загущенных мукой или крахмалом — в присутствии ZnСl2 электролит загустевает гораздо быстрее. Кроме того, растворы ZnС12 обладают антигнилостными и частично буферными свойствами. В присутствии ZnС12 уменьшается тенденция растворов к «выползанию» и к образованию солевых налетов.
В электролит элементов, предназначенных для работы при низких температурах, часто добавляют хлорид кальция, который снижает температуру замерзания раствора. В некоторых случаях для этой же цели вводится хлорид лития.
Так как отдельные компоненты электролита по-разному влияют на положительный и отрицательный электроды, то для пропитки агломератов и диафрагм обычно применяют разные рецептуры. В частности, в электролиты для пастовых диафрагм, соприкасающихся с цинковым электродом, с целью снижения саморазряда вводят от 5 до 15 г/л хлорида ртути (II) (сулемы). Ртуть контактно осаждается на поверхности цинка и амальгамирует ее. С той же целью в электролит иногда добавляют небольшие количества бихромата калия, служащего ингибитором коррозии цинка. В некоторые электролиты добавляют дубители— хромовые квасцы или сульфат хрома, предотвращающие разжижение загущенного электролита при повышенной температуре.
д) Марганцево-цинковые элементы со стабильным напряжением
В 1960-х годах были получены модификации ИДМ, позволившие создать положительный электрод со стабильным напряжением разряда. Эти модификации (η-МпО2) имеют в своей структуре достаточно большое количество конституционной воды, т. е. часть атомов кислорода в решетке замещена гидроксильными группами. Эти формы двуокиси марганца имеют хорошие ионообменные свойства: часть протонов в кристаллической решетке может замещаться на ионы цинка. Вероятно, разряд положительного электрода с гидратированной двуокисью марганца первично протекает по уравнению (3). В самом начале разряда происходит незначительное увеличение рН и напряжение несколько снижается. Вскоре начинается вторичная реакция, связанная с внедрением ионов цинка в двуокись марганца и образованием новой фазы — гетеролита:
MnO2+Mn2++Zn2++2H2O=ZnO*Mn2O3+4H+ (7)
В результате этой реакции подщелачивание раствора приостанавливается. Образующийся гетеролит не изоморфен с двуокисью марганца и не образует с ней фазы переменного состава. По этой причине потенциал положительного электрода не зависит от степени разряженности. Суммарная реакция в элементе, включающая две стадии (3) и (7), описывается простым уравнением
