Механизмы переноса субстанций
1.1 Молекулярный механизм
Молекулярный механизм переноса субстанции обусловлен тепловым движением молекул или иных микроскопических частиц (ионов в электролитах и кристаллах, электронов в металлах). Взаимодействие между молекулами грубо можно представить как "жесткое" отталкивание на малых расстояниях между их центрами (l) и "мягкое" притяжение на больших.
Кинетическая энергия молекул, определяющая среднюю квадратичную скорость их движения в условиях термодинамического равновесия, связана с температурой системы
![]()
откуда может быть найдена средняя квадратичная скорость молекул:
![]()
Как видно, она зависит только от температуры системы и массы молекулы. Так, для молекул кислорода при нормальных условиях (Т = 273 К) Wm=461 м/с = 1660 км/ч. С такими средними скоростями осуществляется тепловое движение молекул.
В зависимости от фазового состояния вещества характер молекулярного движения различен. В газах молекулы движутся хаотически. Вследствие малой плотности системы большую долю времени составляет "свободный пробег", т.е. движение молекул практически без взаимодействия друг с другом. При понижении температуры системы уменьшается кинетическая энергия молекул. Они теряют возможность преодолевать силы межмолекулярного притяжения, и система, конденсируясь, переходит из газового состояния в жидкое. Хаотический характер молекулярного движения при этом в основном сохраняется. Однако в связи со значительным увеличением плотности возрастает роль межмолекулярного взаимодействия, большая доля объема системы становится занятой самими молекулами. Затрудняется выход молекул из своего ближайшего окружения.
При дальнейшем понижении температуры большинство систем переходит в кристаллическое состояние. Кинетической энергии молекулы уже недостаточно для выхода из ячейки, образованной окружающими ее молекулами. Формируется наиболее выгодная с энергетической точки зрения структура кристаллической решетки. Перемещение молекул из одного узла в другой возможно лишь за счет нарушений регулярности структуры - наличия дислокаций, "дырок". Преобладающим является тепловое движение молекул внутри ячейки.
Процедуры осреднения скорости молекул быть различными. Можно проводить осреднение по времени, т.е., выбрав какую-то молекулу, следить за ней и замерять ее скорость в различные моменты времени, а затем сложить все эти значения и поделить на количество измерений n:
![]()
Вследствие хаотичности теплового движения молекул, направления вектора скорости в различные моменты времени были бы различны и при достаточно большом промежутке времени по сравнению со временем "свободного пробега" молекул средняя по времени скорость молекулы для равновесной неподвижной системы была бы равна нулю. Поэтому в качестве характеристики теплового движения используют среднюю квадратичную скорость, величина которой отлична от нуля
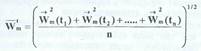
Можно проводить осреднение не по времени, а по объему, т.е. в фиксированный момент времени замерить скорости всех N молекул в выделенном объеме и найти среднее значение скорости:
![]()
Для равновесных систем обе эти процедуры осреднения дадут одинаковые результаты. Разумеется, непосредственное осуществление описанных выше процедур невозможно, так как требует измерения скоростей отдельных молекул, характерный размер которых ~ 10-10 – 10-9. Инженерная практика оперирует макроскопическими величинами, которые описываются непрерывными или кусочно-непрерывными функциями пространственных координат и времени. Абстрагируясь от молекулярного микроскопического представления вещества, на макроуровне рассматривают среду в качестве сплошной. Однако свойства макроскопических объектов обусловлены их микроскопическим поведением. Связать макроскопические непрерывные величины с микроскопическими дискретными позволяет статистическая механика. Оперируя такими понятиями, как функции распределения случайной величины, она дает возможность проводить процедуру осреднения и находить наблюдаемые макроскопические величины, например,
![]()
В статистической механике разработаны и методы определения функций распределения. Так, в условиях равновесия f (Wm) является известной функцией распределения молекул по скоростям Максвелла. Она характеризует плотность вероятности, с которой молекула может двигаться с тем или иным значением скорости. Неравновесная статистическая механика, или, как ее еще называют, кинетическая теория, позволяет определять неравновесные функции распределения и на их основе описывать явления переноса.
Молекула, перемещаясь из одной точки пространства в другую, переносит все три вида субстанции - массу, импульс и энергию. В условиях равновесия, когда система покоится, а концентрации компонентов и температура во всех точках одинаковы, видимого макроскопического переноса субстанций не наблюдается, так как перенос молекул в любом направлении равновероятен. В отсутствие равновесия появляется преобладающая вероятность молекулярного переноса массы в направлении от больших значений концентрации к меньшим, импульса - от больших значений скоростей к меньшим и энергии - от больших температур к меньшим. Это приводит к наблюдаемым макроскопическим явлениям переноса.
Следует обратить внимание на различные составляющие молекулярного механизма переноса для различных субстанций. Так, перенос массы может осуществляться только за счет поступательного переноса, т.е. непосредственного перемещения молекулы из одной точки пространства в другую. Перенос импульса и энергии может происходить как за счет поступательного переноса, так и за счет взаимодействия молекул. Наиболее простой моделью взаимодействия молекул является рассмотрение их как сталкивающихся твердых шаров. Для качественного описания процессов переноса такая модель вполне приемлема. При столкновении молекул происходит изменение их скоростей, что приводит к так называемому столкновительному переносу импульса и энергии.
В разреженных и умеренно плотных газах основную долю в переносе импульса и энергии составляет поступательный перенос. В плотных газах и конденсированных системах увеличивается доля столкновительного переноса, и она становится преобладающей.
1.2 Конвективный механизм
Конвективный механизм переноса субстанции обусловлен движением макроскопических объемов среды как целого. Как уже отмечалось, характерные масштабы инженерных задач позволяют оперировать макроскопическими величинами, которые могут задаваться в каждой точке пространства путем усреднения микроскопических величин. Совокупность значений физической величины, однозначно определенных в каждой точке некоторой части пространства, называется полем данной величины (поле плотности, концентраций, давления, скорости, температуры и т.д.). Выбор дискретной микроскопической или сплошной макроскопической модели для описания явления зависит от масштаба рассматриваемой задачи. Исследуя или проектируя промышленный аппарат, по-видимому, можно с достаточной степенью точности рассматривать в качестве минимальной цены деления пространственных координат 1 мм и временных координат 1 с. Понятию "точки" пространства при такой шкале будет соответствовать объем в 1 мм3. Но в 1 мм3 содержится от 1016 молекул в умеренно плотном газе и до 1019 молекул жидкости. За "момент" времени в 1с произойдет 109-1012 столкновений для каждой молекулы. Проведя осреднение случайных значений молекулярных микроскопических характеристик в системе, состоящей из такого большого числа частиц и претерпевающей значительную по микроскопическим масштабам эволюцию, можно получить с большой степенью вероятности вполне определенное значение макроскопической величины.
