Поверхностное натяжение и адсорбция на границе вода-воздух
Типичная зависимость поверхностного натяжения от времени представлена на рис. 4, б. Поверхностное натяжение в начальный момент времени близко к поверхностному натяжению чистой воды. Динамическое поверхностное натяжение играет важную роль во многих технологических процессах, например в процессе печатания. В этом процессе равновесное поверхностное натяжение никогда не достигается, поэтому характеристика таких систем с помощью равновесного поверхностного натяжения не имеет смысла.
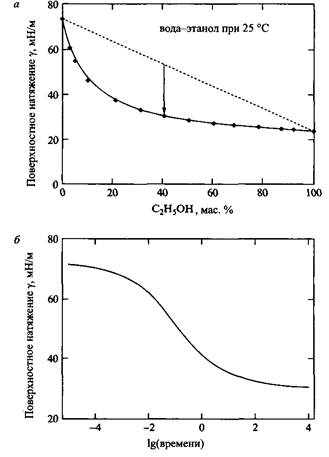
Рис. 4. а — Поверхностное натяжение изменяется от среднеарифметического значения для индивидуальных компонентов до равновесного поверхностного натяжения. С разрешения John Wiley& Sons, Inc б — После образования новой поверхности система релаксирует до равновесного поверхностного натяжения вследствие адсорбции более поверхностно-активных молекул
Наряду со временем, необходимым для диффузии компонента к межфазной границе жидкость-воздух, есть еще две причины временной зависимости поверхностного натяжения. Во-первых, изменение конфигурации больших молекул на поверхности. Для достижения равновесного поверхностного натяжения растворов полимеров обычно требуется довольно продолжительное время. Вторая причина обусловлена присутствием в системе более одного растворенного компонента. В этом случае длительность достижения равновесия определяется конкурентной адсорбцией на поверхности растворенных компонентов.
Связь поверхностного натяжения с адсорбцией
Рассмотрим соотношение между адсорбцией и поверхностным натяжением в рамках теории регулярных растворов. Для обсуждения адсорбции растворенного вещества на поверхности жидкость-воздух необходимо определить, что такое поверхность. Первое определение поверхности восходит к работам Гиббса. Он определил положение поверхности следующим условием: концентрация растворителя равна половине суммы концентраций в объеме растворителя и в равновесном с ним паре. Адсорбция поверхностно-активного вещества обычно обозначается как Г, где индекс указывает, что поверхность и, следовательно, адсорбция определяются растворителем.
Для неионных ПАВ адсорбция связана с поверхностным натяжением уравнением Гиббса:
![]()
где а — активность растворенного вещества в растворе. Поскольку концентрация ПАВ в растворе вплоть до KKM очень мала, активность можно заменить на концентрацию поверхностно-активного компонента С; тогда получаем:
![]()
Адсорбцию поверхностно-активного компонента можно определить по наклону зависимости поверхностного натяжения от логарифма концентрации. На рис. 5 представлены такие зависимости для ряда растворов в воде спиртов с неполярными радикалами средней длины. Зависимости имеют одинаковый наклон. Это указывает на то, что адсорбция не зависит от длины углеводородного радикала. Следует отметить практически линейный характер этих зависимостей при высоких концентрациях, что указывает на постоянство адсорбции). Для мономолекулярной адсорбции количество адсорбированного вещества обратно пропорционально площади поперечного сечения адсорбированной молекулы А. Соотношение имеет вид
![]()
где Г — адсорбция, выраженная в мкмоль/м2.
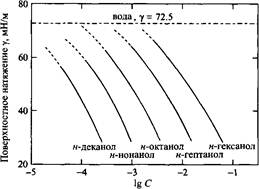
Рис. 5. Зависимости поверхностного натяжения от концентрации водных растворов ряда длинно-цепочечных спиртов
Тот факт, что наклоны кривых, приведенных на рис. 5, одинаковы означает, что нормальные спирты имеют одинаковую площадь на молекулу в адсорбционном слое, независимо от длины гидрофобного радикала. Постоянство площади на молекулу в поверхностном слое для спиртов с гидрофобными радикалами средней длины согласуется с молекулярным упорядочением на поверхности: полярные группы направлены в сторону воды, а неполярные гидрофобные цепи направлены в сторону воздуха.
В случае ионных ПАВ необходимо учитывать, что с молекулами ПАВ ассоциированы противоионы и что поверхность в целом должна быть электронейтральной. Уравнения и принимают при этом вид
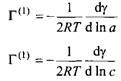
Однако при избытке соли нужно пользоваться уравнениями и. Причина в том, что избыток соли нивелирует влияние противоионов на поверхности, и ПАВ адсорбируется на поверхности как индивидуальный компонент, не сопровождаемый противоионом.
Связь адсорбции поверхностно-активных веществ на границе жидкость-воздух с критическим параметром упаковки
Как и спирты с гидрофобными группами средней длины, поверхностно-активные вещества также адсорбируются на поверхности жидкость-воздух так, что полярные группы направлены в сторону воды, а гидрофобные части молекул — в сторону воздуха. На рис. 6 показаны изотермы поверхностного натяжения этоксилированного алкилсульфата при различных концентрациях соли. Видно, что с увеличением содержания соли а) снижается ККМ, б) предельное поверхностное натяжение при концентрациях выше KKM уменьшается, в) наклон кривых вблизи KKM увеличивается, что указывает на увеличение адсорбции в соответствии с уравнениями. Все три факта указывают на увеличение критического параметра упаковки системы вследствие экранирования противо-ионами полярных групп поверхностно-активного вещества. Из наклона кривых ниже KKM можно определить, что при повышении концентрации соли молекулы ПАВ упаковываются в поверхностном слое плотнее в соответствии с увеличением эффекта экранирования электролитом.
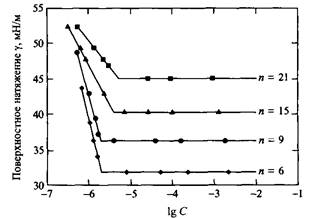
На рис. 7 представлены данные по поверхностному натяжению растворов ряда неионных ПАВ типа Ci6E. Видно, что НПАВ с более короткими полиокси-этиленовыми цепями лучше упаковываются на поверхности вода - воздух, и наклон зависимостей поверхностного натяжения от Ig С вблизи KKM в этом случае больше. Все это согласуется с концепцией КПУ; в частности, последний увеличивается с уменьшением длины полиоксиэтиленовой цепи в молекулах ПАВ. Отметим также, что поверхностное натяжение при KKM и выше KKM понижается, по мере того как полиоксиэтиленовые цепи становятся короче. При этом заметного влияния на величину KKM не отмечается.
На рис. 8 представлены изотермы поверхностного натяжения растворов соединений СЕб при разных температурах. Известно, что при повышении температуры полиоксиэтиленовые цепи сжимаются, что приводит к увеличению КПУ. Из этого рисунка видно, что в результате происходит понижение поверхностного натяжения и ККМ. Детальный анализ также показывает, что адсорбция НПАВ при концентрациях ниже KKM увеличивается с повышением температуры, а следовательно, площадь на молекулу в поверхностном слое уменьшается с повышением температуры.
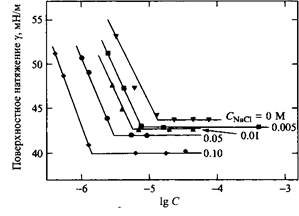
Рис. 6. Поверхностное натяжение растворов CieEsSO4Na при различных концентрациях соли