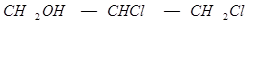Получение аллилового спирта гидролизом хлористого аллила
8. Взаимодействие с магнийгалогеналкилами
Происходит замещение гидроксильного водорода на магнийгалоген и выделение углеводорода [10]:
![]() .
.
9. Взаимодействие с хлористым фосфором - PCl3 [31]
Треххлористый фосфор дает хлористый аллил C3H5Cl, изомерный с α- и β – хлорпропиленами:
![]() .
.
Аналогичным путем образуется йодистый аллил C3H5J:
![]() .
.
10. Гидратация под действием слабых минеральных кислот
При действии слабых минеральных кислот аллильный спирт способен присоединять элементы воды, причем превращается в пропиленгликоль который, вновь теряя воду, переходит уже в изомерный с аллиловым спиртом пропионовый альдегид или его продукты конденсации [24]:
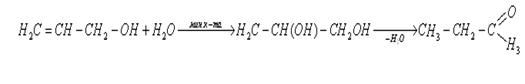
1.3.3.2 Химические свойства хлористого аллила [10]
Свойства обусловлены легкостью замещения атома галогена.
1. Омыление хлористого аллила раствором шелочи [24]:
![]() .
.
2. Взаимодействие с минеральными кислотами с образованием дихлоргидринов
Например, взаимодействие хлористого аллила с хлорноватистой
кислотой, которая присоединяется по двойной связи. При этом образуются два изомера [33]:
|
|
|
|
|
α – дихлоргидрин |
β – дихлоргидрин |
|
(1,3 – дихлорпропанол – 2 ) |
(1,3 – дихлорпропанол – 2) |
1.3.3.3 Химические свойства воды [12, 44, 46 - 50]
Вода взаимодействует со многими веществами при обычной температуре.
1. Взаимодействие с активными металлами
Со щелочными и щелочноземельными металлами, с их окислами вода образует гидроксиды металлов и водород:
2H2O + Ca = Ca(ОН)2 + H2![]() ,
,
2H2O + 2Na = 2NaOH + H2![]() .
.
Благородные металлы с водой не реагируют.
2. Взаимодействие с галогенами
Вода относится к химически активным соединениям, реагирует с фтором:
H2O + F2 = HF + O· (выделяется атомарный кислород),
O·+ F2 = ОF2 и др.
Хлор при нагревании или на свету разлагает воду с выделением атомарного кислорода:
H2O + Cl2 = HCl + HClO.
3. Взаимодействие с неметаллами
Вода вступает в реакцию и со многими неметаллами. Например, при взаимодействии с атомарным кислородом образуется пероксид водорода:
H2O + O = H2O2.
А при взаимодействии с фосфором образует фосфорную кислоту:
8H2O +2Р = 2Н3РО4+ 5 Н2![]() .
.
4. Взаимодействие с оксидами с образованием кислот и оснований
Многие оксиды реагируют с водой, образуя основания:
CaO + H2O = Ca(OH)2,
Na2O + H2O = 2 NaOH.
И кислоты:
CO2 + H2O = H2CO3,
3H2O +Р2О5= 2Н3РО4.
5. Взаимодействие с солями с образованием кристаллогидратов
При взаимодействии с некоторыми солями образуются кристаллогидраты. При нагревании они теряют кристаллизационную воду:
Na2CO3 + 10H2O = Na2CO3·10H2O,
Na2CO3·10H2O ![]() Na2CO3 + 10H2O,
Na2CO3 + 10H2O,
СuSO4 + 5H2O = CuSO4·5H2O
Белый голубой
CuSO4·5H2O![]() СuSO4 + 5H2O
СuSO4 + 5H2O
6. Разложение воды.
Происходит под действием электрического тока:
![]() .
.
При этом на катоде выделяется водород, а на аноде – кислород.
7. Гидролиз.
Вода также разлагает большинство солей:
AlCl3+ 3H2O=Al(OH)3 + 3HCl,
Al2S3+ H2O=Al(OH)3 + H2S.
Вода разлагает гидриды, фосфатиды, нитриды, силициды, бориды активных металлов.
NaH + H2O = NaOH + H2
8. Взаимодействие с органическими веществами
Присоединение по тройной связи:
![]() СН
СН![]() СН + НОН
СН + НОН ![]() СН3-С=О .
СН3-С=О .
Н
И двойной связи:
CH2=CH2 + H2O ![]() CH3-CH2OH.
CH3-CH2OH.
С галогензамещенными алканами:
Cl-CH2-CH3 + H2O ![]() CHOH-CH3 + HCl.
CHOH-CH3 + HCl.
1.3.3.4 Х имические свойства соляной кислоты [12, 44, 46 - 50]
1. Раствор HCl в воде - соляная кислота - сильная кислота, она полностью диссоциирует на ионы:
HCl = H+ + Cl- .
2. Взаимодействие с металлами, стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl3 + 3H2.
3. Взаимодействие с оксидами металлов:
MgO + 2HCl = MgCl2 + H2O.
4. Взаимодействие с основаниями и аммиаком:
HCl + KOH = KCl + H2O.
3HCl + Al(OH)3 = AlCl3 + 3H2O,
HCl + NH3 = NH4Cl.
5. Взаимодействие с солями:
CaCO3 + 2HCl = CaCl2 + H2O + CO2.
HCl + AgNO3 = AgCl + HNO3.
6. Вытесняет галогены из солей:
KJ + HCl = KCl + HJ.
2. Термодинамический анализ основной реакции
2.1 Подготовка исходной информации
При проектировании технологических процессов важное место занимают термодинамические расчеты химических реакций. Цель термодинамического анализа заключается в определении принципиальной возможности проведения химической реакции в данных условиях, в расчете теплового эффекта реакции, константы равновесия при различных температурных режимах, а также в выборе условий проведения процесса с наибольшей эффективностью.
Для того чтобы более наглядно продемонстрировать характер изменения термодинамических величин, рассмотрим интервал температур от 80 0С
(353 K) до 180 0С (453 K).
Для исследуемой реакции:
![]() .
.
рассчитывается значение энтальпии (![]() Н0298), энтропии (
Н0298), энтропии (![]() S0298) и температурных коэффициентов (а, в, с, d, с’) при температуре 298 К для всех веществ участвующих в реакции. Все термодинамические данные взяты из справочников [6, 40, 41, 51]. Эти данные представлены в табл. 2.
S0298) и температурных коэффициентов (а, в, с, d, с’) при температуре 298 К для всех веществ участвующих в реакции. Все термодинамические данные взяты из справочников [6, 40, 41, 51]. Эти данные представлены в табл. 2.