Получение хлора при электролизе хлорида алюминия
Рассматриваемые отходы содержат в своем составе ценные компоненты, при переработке которых можно получить существенный экономический и экологический эффект.
Для эффективной утилизации отходов необходимо исследовать и разработать безотходную технологию, наносящую минимальный экологический ущерб окружающей среде, имеющую низкие капитальные затраты на ее реализацию и позволяющую получать прибыль. Этому посвящена данная работа.
В исследованиях в качестве отходов использовали алюминийфторуглеродсеросодержащий шлам Красноярского алюминиевого завода (ОАО "РУСАЛ Красноярск"), отобранный со шламового поля с влажностью 30% и высушенный при температуре 100°С. Шлам представляет собой механическую смесь пыли электрофильтров, шлама "мокрой" ступени газоочистки, хвостов флотации угольной пены и содержит, % масс. 8,15А1; 0,15 Si; 0,97 Fe; 0,01 Ti; 0,76 Са; 0,27 Mg; 6,46 Na; 1,06 К; 7,085 R (R = Na+K в пересчете на Na); 1,25 S; 10,31 F; 51,6 C; 58,11 п.п.п. (потери при прокаливании). По крупности шлам имеет частицы размером менее 0,05 мм 74,19% и более 0,2 мм 4,37%. Для разработки технологии переработки алюминийфторуглеродсеросодержащих отходов алюминиевого производства и их обезвреживания представляет интерес исследовать поведение при нагреве содержащихся в них фторидов в смеси с СаС03 и Na2C03 и углерода, предполагая, что при этом углерод будет сгорать в воздухе, а фториды прореагируют по следующим химическим реакциям:
2NaF + СаСОз = CaF2 + Na2C03; (1)
2Na3AlF6 + бСаСОз = Na20-Al203 + 6CaF2 + 2Na2C03 + 4C02T; (2)
2A1F3 + 3CaC03 = 3CaF2 + A1203 + 3C02;(3)
2A1F3 + 4Na2C03 = Na20-Al203 + 6NaF + 4C02; (4)
CaF2 + Na2C03 = 2NaF + CaO + C02T; (5)
CaF2 + Na2C03 = 2NaF + CaC03. (6)
С этой целью были приготовлены согласно стехиометрическим коэффициентам в вышеприведенных реакциях следующие смеси веществ марки ч.д.а. крупностью менее 0,08 мм:
2NaF + СаСОз (1), 2Na3AlF6 + 6СаС03 (2), 2A1F3 + ЗСаСО3 (3),
2A1F3 + 4Na2C03 (4), CaF2 + Na2C03 (5).
Указанные смеси и используемый в исследованиях алюминийфтроруглеродсеросодержащий шлам проанализированы дифференциально-термическим (ДТА) и термогравиметрическим (TG) методами.
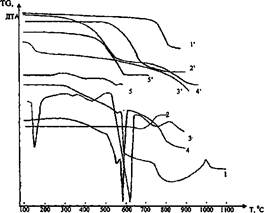
Рис. 1. Термогравиметрический анализ смесей фторидов с известняком и содой.
1, 1' - смесь NaF + СаС03; 2, 2' - смесь A1F3 + СаС03; 3, 3' - смесь Na2C03 + CaF2;
4, 4' - смесь Na3AlF6 + CaC03; 5, 5' - смесь A1F3 + Na2C03.
1, 2, 3, 4, 5 - кривые ДТА; Г, 2', 3', 4', 5' - кривые TG
Проведенные исследования подтвердили предположение, что фториды разлагаются известняком и содой при температуре 600-650°С по вышеприведенным реакциям (1-6).
По кривым 1, Г видно, что реакция 1 начинается при температуре 420°С, но идет очень медленно. С повышением температуры скорость ее увеличивается, достигая максимума при 530-590°С, и при 600°С она практически заканчивается полным переходом растворимого в воде NaF в нерастворимый CaF2, о чем свидетельствует большой эндотермический эффект на кривой ДТА. При нагревании смеси 2NaF + СаС03 до температуры 620°С практически не наблюдается убыль веса (кривая Г). Это указывает на то, что протекает обменная химическая реакция взаимодействия NaF и СаС03 с образованием CaF2 и Na2C03. Однако при температуре более 620°С образовавшиеся CaF2 и Na2C03, по-видимому, взаимодействуют между собой с образованием снова NaF по реакциям 5 и 6, о чем свидетельствует изменение угла наклона кривой ДТА (кривая 1). Причем до температуры 750°С преимущественно протекает реакция 6, так как на кривой TG (1') отмечается небольшая убыль веса, а при температуре более 750°С в основном идет реакция 6 с образованием, кроме NaF, СаО и улетающего в атмосферу углекислого газа, что резко увеличивает убыль веса (кривая Г).
Реакция 2 между криолитом и известняком начинается при температуре 320°С и заканчивается при температуре 620°С с полным переходом алюминия в алюминат натрия. Образовавшиеся при этом CaF2 и Na2C03 реагируют также между собой при температуре более 620°С по реакциям 5 и 6 (кривые 2 и 2'). Реакция 3 между фторидом алюминия и известняком начинается при температуре 540°С, идет активно и при 710-730°С заканчивается полностью (кривые 3 и 3').
Фторид алюминия начинает реагировать с содой по реакции 4 при температуре 490°С, а с известняком — по реакции 3 при температуре 540°С, и заканчивается реакция 4 при температуре 590-600°С, что видно из кривых ДТА и TG (кривые 4 и 4'). Поэтому следует ожидать, что сода, образовавшаяся по реакциям 1, 2 прореагирует с A1F3 с образованием алюмината натрия, а не оксида алюминия по реакции 3.
На кривой ДТА шлама (кривая 6) в области температур 350-915 °С наблюдается большой экзотермический эффект с максимумом при 620"С, относящийся, по-видимому, к горению углеродистой массы, которому соответствует убыль массы образца (кривая 6'). Видно, что углерод в шламе горит в широком температурном интервале, что свидетельствует о присутствии в шламе различных его модификаций. Нами установлено, что теплотворная способность углеродистого шлама составляет 12544,8-14635,6 кДж/кг (3000-3500 ккал/кг).
Предварительно расчетом было установлено, что молярные отношения в шламе R:A1 = R2O: AI2O3 = 1,02 ед., т.е. для образования алюмината натрия (Na2O.Al2O3) в спеке вводить дополнительно щелочь в шихту для спекания не следует. Поэтому исследования проводили по спеканию шлама только с известняком.
В отходах алюминиевого производства содержатся, как было отмечено выше, от 0,1 до 1,3% серы в виде, главным образом, растворимых сульфатов щелочных металлов (Na2S04 и K2SO4), которые при спекании не взаимодействуют с глинозёмом и не образуют алюмината, т.е. являются инертными по отношению к глинозёму [6]. Поэтому важно при спекании серу перевести в нерастворимую форму — CaSO4, а сульфаты натрия и калия в активную форму — карбонаты по химическим реакциям:
(Na,K)2S04 + 2С + СаСОз = (Na,K)2C03 + CaS + 2C02; (7)
CaS+ 2O2 = CaS04. (8)
При выщелачивании спека сера уходит в осадок в виде CaS04. Из стехнометрических коэффициентов реакций 7, 8 видно, что для образования в спеке CaS04 и CaS в шихте должно быть молярное отношение Са: S = 1,0. Поэтому в шихтах для спекания шлама нами выдерживалось это отношение.
Образующиеся по реакции 7, 8 карбонаты щелочных металлов взаимодействуют с AIF3 по реакции 4, образуя в спеке легкорастворимые алюминаты — (Na,K)20- AI2O3. Без добавки в шихты известняка для связывания серы в CaS04 щелочь в составе сульфатов не образует алюминатов и снижает извлечение глинозёма из спека (отходов).
Для исследования влияния режимов спекания и состава шихты на качество получаемого спека нами были рассчитаны и приготовлены шихты, состоящие из алюминийфторуглерод-серусодержащего шлама ОАО "РУСАЛ Красноярск" и известняка марки ч.д.а. с различными молярными отношениями Ca:F2(oт 0,86 ед. до 1,10 ед.) и постоянными Ca:S = 1,0 ед., R:A1 = 1,02 ед. Характеристика шихт приведена в табл. 1.
