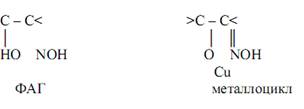Применение органических реагентов в аналитической химии
СОДЕРЖАНИЕ
1. Введение
2. Реакции, основанные на образовании комплексных соединений металлов
2.1 Внутрикомплексные соединения
2.2 Хелатные комплексные соединения
2.3 Понятие о функционально-аналитической и аналитико-активной группах
3. Реакции без участия комплексных соединений металлов
3.1 Образование окрашенных соединений с открываемым веществом
3.2 Образование органических соединений, обладающих специфическими свойствами
4. Использование органических соединений в качестве индикаторов титриметрических методов
4.1 Теории кислотно-основных индикаторов
4.2 Индикаторы группы азосоединений
4.3 Трифенилметановые индикаторы
4.4 Нитроиндикаторы
4.5 Индикаторы других структурных групп
Заключение
Использованная литература
1. ВВЕДЕНИЕ
Органические вещества широко применяются в аналитической химии вообще и в фармацевтическом анализе, в частности. Ещё с начала нашей эры было известно, что настой чернильных дубильных орешков можно было применять в качестве пробы на железо. Много столетий спустя (1815 год) было установлено, что крахмал в присутствии йода окрашивается в синий цвет. Первым синтетическим специфическим органическим реагентом для химического анализа считается реактив Грисса-Илошвая (предложен П. Гриссом в 1879 году и подробно изучен Л. Илошваем в 1889 году) – смесь α-нафтиламина и сульфаниловой кислоты, которая даёт красную окраску с нитрит-ионами. В 1885 году М.А. Ильский и Г. Кнорре предложили α-нитрозо-β-нафтол в качестве реагента для открытия и определения кобальта. Эта реакция оказалась примерно в 120 раз чувствительнее применявшейся ранее аналитической реакции катионов кобальта с нитритом калия. В 1905 году Л.А. Чугаев в работе «О новом чувствительном реагенте на никель» предложил диметилглиоксим в качестве реагента на никель и затем в своей докторской диссертации (1906) изложил результаты исследований в рассматриваемой области. Предложенный Чугаевым диметилглиоксим и поныне является непревзойдённым аналитическим реагентом на никель.
В настоящее время известно очень большое число синтетических органических реагентов, применяемых в химическом анализе, благодаря трудам И.П. Алимарина, А.К. Бабко, Р. Берга, В.А. Назаренко и других исследователей.
2. РЕАКЦИИ, ОСНОВАННЫЕ НА ОБРАЗОВАНИИ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ
При таких аналитических реакциях преимущественно (хотя и не всегда) применяются циклообразующие лиганды, способные к построению хелатных комплексов, особенно – внутрикомплексных соединений и комплексонатов металлов. Молекулы подобных лигандов должны содержать функционально-аналитические группы (ФАГ), способные образовывать с атомами металлов-комплексообразователей относительно прочные координационные связи, чаще всего – устойчивые металлоциклы. В состав ФАГ могут входить группы ОН, SH, NH, C=O, C=S, гетероатомы азота и др.
В химическом анализе используют комплексные соединения практически всех типов – катионного, анионного, комплексы-неэлектролиты, комплексы с неорганическими и органическими лигандами, моноядерные, многоядерные и т. д. Кратко охарактеризуем наиболее часто используемые в химическом анализе комплексных соединений.
2.1 Внутрикомплексные соединения
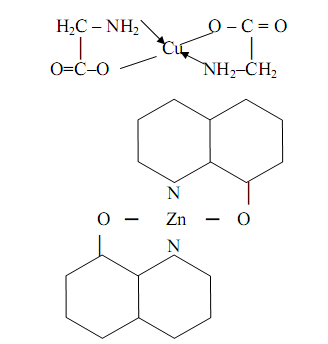
Внутрикомплексные соединения (ВКС) – координационные соединения металлов с одинаковыми или различными бидентатными (обычно-органическими) ацидолигандами, связанными с одним и тем же атомом металла комплексообразователя через одну отрицательно заряженную и одну нейтральную донорные группы с образованием одинаковых или различных внутренних металлоциклов (хелатных циклов), не содержащие внешнесферных ионов и являющиеся комплексами-неэлектролитами. Примером ВКС могут служить глицинат меди (II) и оксихинолинат цинка:
К ВКС относятся также такие практически важные соединения, как оксихинолинаты металлов состава MLn (L – депротонированный по венольной группе остаток 8-оксихинолина, n – степень окисления металла М), комплексы металлов с оксиоксимами, нитрозогидроксиламинами, нитрозофенолами, различными аминокислотами и др.
2.2 Хелатные комплексные соединения
ВКС представляют собой частный случай хелатных комплексных соединений (хелатов) металлов (ХКС), т. е. координационных соединений металлов с одинаковыми или различными отрицательно заряженными или нейтральными полидентатными лигандами (органическими или неорганическими), имеющих один или несколько одинаковых или различных хелатных циклов. Термин «хелат» предложен в 1920 году Морганом и Дрю. Хелаты, в отличии от ВКС, могут быть комплексами катионного, анионного типа или комплексами-неэлектролитами, содержать во внутренней координационной сфере или только полидентатные, или одновременно один или несколько полидентатных и монодентатные лиганды и иметь или не иметь внешнесферные ионы. Различия между ВКС и ХКС иногда (но не всегда) не делается: любые ХКС, содержащие хотя бы один хелатный цикл, нередко называется ВКС. В ХКС один и тот же полидентатный лиганд образует один или несколько хелатных циклов, причём этот лиганд может быть би-, три-, тетра-, пента-, гексадентатным. Так, в комплексах 8-оксихинолином (оксином) реализуются пятичленные металлоциклы:
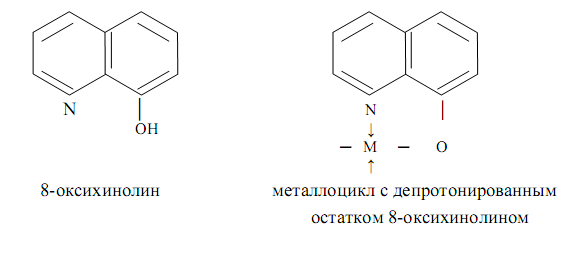
Примером может служить вышеописанный оксихинолинат цинка или оксихинолинат магния MgL2 (символом HL обозначена молекула 8-оксихолина), осаждающийся из растворов в виде осадка темно-зелёного цвета и используемы для определения магния.
Большую группу хелатных комплексов образует этилендиамин H2NCH2CH2NH2 (часто для краткости обозначаемый En или en), дающий пятичленные металлоциклы, например, в комплексе платины(II)
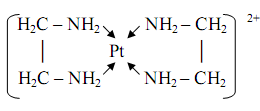
Два идентичных металлоцикла содержаться в комплексе кобальта(III) наряду с двумя монодентатными тиоцианатогруппами:
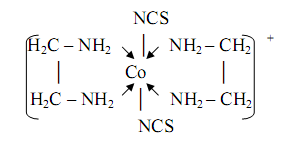
Этот комплекс применяется для определения серебра(I), висмута(III) в форме соединений [CoEn2(NCS)2][Ag(NCS)2] и [CoEn2(NCS) 2] [BiI4].
К ХКС относятся такие практически важные вещества, как соединения металлов с основаниями Шиффа, комплексонаты, фталоцианины металлов, порфирины, хлорофилл, гемоглобин, цианокобаламин, инсулин, ферритин и многие другие.
2.3 Понятие функционально-аналитических и аналитико-активных группах
ВКС – обычно малорастворимые в воде, часто – окрашенные вещества, могут экстрагироваться (иногда избирательно) органическими растворителям, не смешивающимися с водой. ХКС обладают различными растворимостью и окраской, зависящими от природы как металла-комплексообразователя, так и лигандов внешней сферы
Так, например, ионы меди(II) Cu2+ при взаимодействии с органическими соединениями – α-ацилоиноксимами – образуют комплексы зелёного цвета, содержащие пятичленные металлоциклы: