Применение органических реагентов в аналитической химии
3. РЕАКЦИИ БЕЗ УЧАСТИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ
3.1 Образование окрашенных соединений с открываемыми веществами
Дифениламин (C6H5)2NHпри реакциях в кислой среде с соединениями, содержащими окислители (NO2ˉ, NO3ˉ, BrO3ˉ, CrO42ˉ, MnO4ˉ, Fe3+ и др. ) окрашивает раствор в синий цвет вследствие необратимого окисления дифениламина в синий дифенилдифенохинондиимин. Эта реакция – фармакопейная, используется для открытия, например, нитратов и нитритов. С нитратами реакция протекает по схеме:
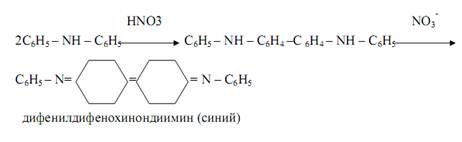
При выдерживании смеси синяя окраска постепенно переходит в бурую, а затем в жёлтую. Определению мешают сильные восстановители – такие, как сульфид-ион S2ˉ, сульльфит-ион SO32ˉ, тиосульфат-ион S2O32ˉ, иодид-ион Iˉ.
Антипирин используют для открытия нитрит-ионов NO2ˉ (реакция фармакопейная). В кислой среде (HCl, H2SO4) нитриты образуют с антипирином нитрозоантипирин изумрудно-зелёного цвета:
NO2ˉ + H3O+ = HNO2 + H2O
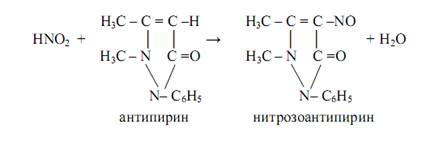
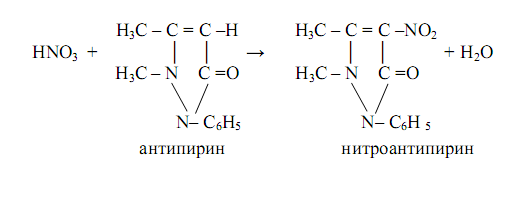
Нитраты образуют с антипирином в сильнокислой среде (концентрированная серная кислота) ярко-красный нитроантипирин
Выше уже упоминался реактив Грисса-Илошвая в качестве аналитического реагента на нитрит-ионы NO2ˉ . При взаимодействии смеси сульфаниловой кислоты и 1-амино-2-нафтола с нитритами в нейтральных или уксуснокислых растворах образуется азокраситель ярко-красного цвета (реакция Грисса):
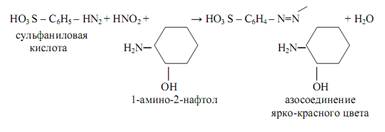
Реакция весьма чувствительная: открываемый минимум m=0, 01 мкг. Нитрат-ион NO3ˉ такой реакции не даёт.
Аналогично протекает реакция также в том случае, если вместо 1-амино-2-нафтола взять β-нафтол: развивается красная окраска.
Вместо сульфаниловой кислоты в этой реакции можно использовать различные другие ароматические амины, которые в щелочной среде с 1-нафтиламином или 1-нафтолом (а также с производными анилина, например, диметиланилином) дают окрашенные азокрасители.
Этакридин (риванол) в кислой среде образует с нитратами диазоэтакридин красного цвета:
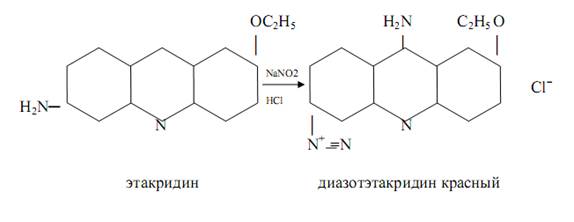
Реакция специфична для нитратов.
Борат-ионы BO3ˉ , B4O72- открывают с помощью куркумовой бумаги – бумаги, обработанной раствором органического красителя – куркумина. Соли борной кислоты окрашивают в кислой среде куркумовую бумагу в розовый цвет. Щёлочи и аммиак изменяют окраску на синюю или буровато-зелёную. Реакция – фармакопейная. В качестве возможной предполагается следующая схема протекания реакции:
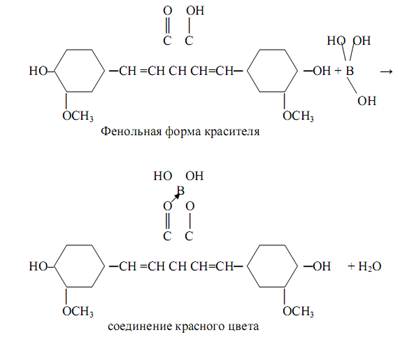
Окрашенные соединения с борной кислотой образуют также оксиантрахиноны - ализарин, пурпурин, хинализарин – в среде концентрированной серной кислоты.
Реакция образования окрашенных соединений с органическими реагентами используются для определения подлинности многих лекарственных препаратов или открытия входящих в них групп, например, органических кислот; соединений, содержащих гидроксильные, альдегидные, кетонные, эфирные, имидные группы, аминогруппы, фенильные радикалы; алкалоидов, гликозидов сердечного действия, витаминов, гормонов и их синтетических аналогов, антибиотиков и других веществ.
3.2 Образование органических соединений, обладающих специфическими свойствами
В ряде случаев в химическом анализе используют такие реакции с участием органических реагентов, в результате которых образуются продукты реакции, обладающие специфическими свойствами – запахом, окрашиванием пламени газовой горелки и т. д. Так, реакция образования сложных эфиров используется для открытия ацетат-ионов CH3СООˉ, борат-ионы BO3ˉ, B4O72- . Открытие ацетат-ионов проводится в кислой среде. При этом ацетат-ионы, присоединяя ион водорода, переходят в слабую уксусную кислоту. При реакции с этанолом уксусная кислота даёт уксусноэтиловый эфир, обладающий характерным запахом:
CH3СООˉ + Н3О+ = CH3СООН + Н2О
CH3СООН + НOC2H5 = CH3СОО C2H5 + Н2О
Реакция – фармакопейная.
Летучие сложные эфиры борной кислоты окрашивают пламя в зелёный цвет. В присутствии серной кислоты и этанола борат-ионы образуют сложные эфиры:
B4O72- + Н+ + 5Н2О = Н3BO3
Н3BO3 + 3C2H5OН→ В(ОC2H5)3 + 3Н2О
При поднесении пламени к чашке или тиглю, в которых протекает эта реакция, продукты сгорания окрашивают пламя в зелёный цвет. Реакция – фармакопейная.
4. ИСПОЛЬЗОВАНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В КАЧЕСТВЕ ИНДИКАТОРОВ В ТИТРИМЕТРИЧЕСКИХ МЕТОДАХ КОЛИЧЕСТВЕННОГО АНАЛИЗА
4.1. Теории кислотно-основных индикаторов
Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи её. Кислотно-основные индикаторы в кислых и щелочных растворах имеют различную окраску. Иак, лакмус в кислой среде (рН < 7) окрашен в красный цвет, а в щёлочной (рН>7) – в синий; фенолфталеин в кислой – бесцветен, в щелочной – имеет красную или малиновую окраску.
Для объяснения природы изменения окраски индикаторов было предложено несколько теорий. Ионная теория кислотно-основных индикаторов предполагает наличие в растворе двух форм молекулы индикатора – кислой формы, имеющей один цвет, и основной формы, имеющей другой цвет. В зависимости от рН раствора и соответственно от преобладания той или иной формы, происходит окрашивание раствора в соответствующий форме молекулы индикатора цвет.
Хромофорная теория кислотно-основных индикаторов объясняет наличие окраски индикаторов, являющихся органическими соединениями, присутствием в молекулах индикаторов хромофорных групп. В роли хромофорных групп могут выступать такие группировки атомов и связей, как
