Применение органических реагентов в аналитической химии
При реакциях ионов кадмия Cd2+ c органическми реагентами состава Ar-N=N-NH-Ar' (Ar и Ar' – арильные радикалы), содержащими в качестве ФАГ диазоаминокруппу, образуются комплексы красного цвета.
Сурьма (III) даёт малорастворимые белые осадки комплексов с лигандами, имеющими в качестве ФАГ две соседние фенольные группы в ароматическом ядре, наример с пирогаллолом. Образующиеся комплексы содержат пятичленные металлогруппы:

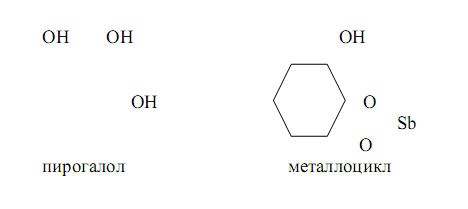
В настоящее время известно значительное число ФАГ.
Наличие ФАГ в органической молекуле является необходимым, но не всегда достаточным условием, позволяющим использовать данное органическое соединение в качестве аналитического реагента. Требуется также во многих случаях присутствие аналитико-активных групп (ААГ), обычно не образующих непосредственно координационные связи с центральным атомом металла-комплексообразователя, но усиливающих аналитический эффект ФАГ. Сочетание ФАГ, ААГ вместе с центральным атомом определяемого металла даёт «аналитический узел», играющий решающую роль в соответствующей аналитической реакции. Понятие о ФАГ и ААГ было введено Л. М. Кульбергом. К некоторым основным критериям применения внутрикомплексных соединений в химическом анализе относятся:
а) малая растворимость комплексного соединения в тех случаях, когда их используют для осаждения ионов металлов из растворов;
б) наличие интенсивной характерной окраски образующихся комплексов, если их используют для открытия или определения ионов металлов по окраске раствора;
в) достаточно высокая устойчивость образующихся комплексов (большие значения констант устойчивости).
Для обеспечения этих критериев необходимо соблюдение, по крайней мере, следующих условий:
1) молекулы органических реагентов должны содержать ФАГ;
2) ФАГ должен иметь такую пространственную конфигурацию и взаимное расположение донорных атомов (азота, кислорода, серы, фосфора, мышьяка и др.), чтобы могла реализоваться возможность образования наиболее устойчивых пяти- и шестичленных металлоциклов;
3) молекула органического лиганда должна иметь, По-возможности, большую молекулярную массу – это понижает погрешности определения металлов.
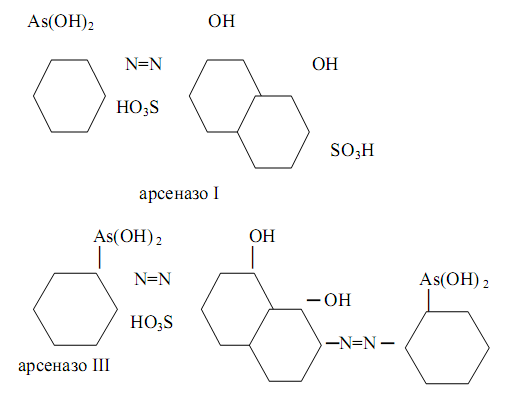
На практике процессы комплексообразования часто сочетают с экстракцией. Некоторые органические реагенты позволяют открывать определять целый ряд катионов. К числу таких органических реагентов относятся соединения группы арсеназо, содержащие мышьяк, азогруппы, SO3H, ОН (арсеназо I, арсеназо II, арсеназо III, полиарсеназо), например Так, с помощью арсеназо I можно определить уранильную группу UO22+ , катионы кальция Ca2+ , бериллия Be 2+ , меди Cu2+ , кобальта Co2+ , никеля Ni2+ , алюминия Al3+ , редкоземельных металлов титан (III), цирконий (IV), торий (IV), ванадий (V), ниобий (V), тантал (V), а также анионы F ˉ , BF4ˉ.
Арсеназо III позволяет определить катионы Be2+, Mg2+, Ca2+, Zn2+, Cd2+, Hg2+, Al3+, Pb2+, редкоземельных металлов, титан (III), цирконий (IV), торий (IV), гафний (IV).
К числу достаточно распространённых в химическом анализе относятся, например, такие органические реагенты, как дитизон, диметилглиоксим, 1-нитрозо-2-нафтол.
Дитизон, или дифенилтиокарбазон
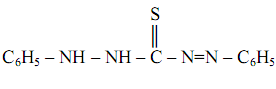
(часто сокращённо обозначается Н2Dz ) впервые был предложен в качестве реагента на катионы Zn2+ , с которыми он образует комплекс малинового цвета – дитизонат цинка Zn(НDz)2,растворимый в хлороформе и в тетрахлориде углерода. Реакция – весьма чувствительная: предел обнаружения m=0, 025 мкг, предельное разбавление V lim =104 мл/г.
Дитизон используется также для определения Cu(II), Ag(I), Au(III), Cd(II), Hg(II), In(III), Tl(I), Pb(II), Bi(III), Co(II), Ni(II), Pd(II), Pt(II) и некоторых других ионов.
Как лиганд дитизон может выступать в форме анионов НDzˉ и НDz2-, образуя комплексы состава Cd(НDz)2, Ag2Dz, Pb(НDz)2, PbDz, PdDz и так далее.
Диметилглиоксим (диацетилдиоксим, реактив Чугаева)
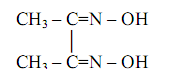
Это – классический органический реагент, впервые предложенный, как уже отмечалось, Л.А. Чугаевым в 1905 году в качестве специфического селективного реагента на никель.
Ионы Ni2+ образуют с диметилглиоксимом в водной среде объёмистый осадок красного цвета, малорастворимый в воде и в водном аммиаке, но растворимый в минеральных кислотах. Реакция протекает по схеме:
Ni2+ + HDMG→ [Ni(DMG)2] + 2Н+
где HDMG – сокращённое обозначение молекулы диметилглиоксима. Структурная формула образующего комплекса будет выглядеть следующим образом:
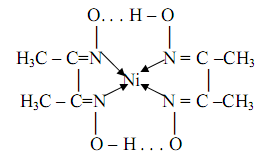
где точками обозначены внутримолекулярные водородные связи. Этот нейтральный комплекс никельдиметилглиоксим и является показателем наличия ионов никеля в растворе. Осаждение обычно проводят из разбавленных аммиачных растворов при рН=8-9. Комплекс очень устойчив; логарифм константы устойчивости равен lgβ=17, 32. Реакция весьма чувствительна: предел обнаружения m=0, 16 мкг, предельное разбавление Vlim =3∙105 мл/г. Поскольку диметилглиоксим малорастворим в воде, то предложено использовать не сам диметилглиоксим, а его двунатриевую соль, которая растворяется в воде. С помощью диметилглиоксима можно определять также и палладий(II), железо(II), висмут(III), кобальт(III). При определении никеля для устранения мешающего действия висмута, железа и кобальта ионы последних маскируют введением тиогликоевой кислоты. Небольшое количество ионов кобальта и железа можно также маскировать введением винной кислоты. Для маскирования больших количеств этих ионов рекомендуют прибавлять в раствор добавки N,N-ди(оксиэтилен)глицина. Диметилглиоксим используют и при фотометрическом определении никеля в присутствии окислителей.
1-Нитрозо-2-нафтол (α-нитрозо-β-нафтол, или реактив Ильинского)
также считается классическим органическим аналитическим реагентом. Впервые он был предложен М.А. Ильинским и Г. Кноре для гравиметрического определения кобальта в форме комплекса СоIIIL3, где HL – молекула 1-нитрозо-2-нафтола. Комплекс выделяется из растворов в виде пурпурно-красного осадка. Точная структура комплекса пока не известна. Предполагается возможность осуществления как пяти-, так и шестичленных хелатных металлоциклов типа
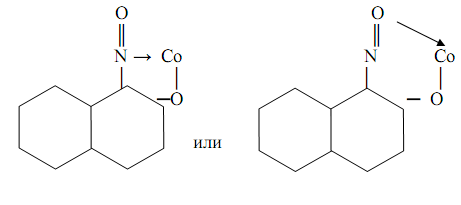
Комплекс очень устойчив: логарифм константы устойчивости lgβ=17. Реакция весьма чувствительна: предел обнаружения m=0, 5 мг, предельное разбавление Vlim =3∙10-5 мл/г. С использованием 1-нитрозо2-нафтола можно также определять также никель, палладий, железо.
Разработана фотометрическая методика определения кобальта с помощью рассматриваемого органического реагента.
