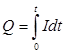Разработка методики определения ультрамикрограммовых количеств тяжелых металлов методом инверсионной вольтамперометрии
Таблица 1.3. Методы, применяемые при исследовании инверсионного процесса 3
| Контролируемый параметр | Измеряемая функция | Название метода |
|
Стационарные методы | ||
|
j |
I = f(j) |
Вольтамперометрия при постоянном потенциале |
|
j |
|
Кулонометрия при постоянном потенциале |
|
j |
Q = f(c) |
Полярографическая кулонометрия |
|
I |
Q = It |
Кулонометрия при постоянном токе |
|
Нестационарные (потенциостатические) методы | ||
|
j |
I = f(t) |
Хроноамперометрия |
|
j = ji + wt |
I = f(j) |
Полярография и вольтамперометрия с переменным потенциалом (single sweep, multi-sweep) |
|
j + j(t) |
I(t) = f(j) |
Полярография и вольтамперометрия с наложением переменного напряжения (переменнотоковая полярография квадратноволновая полярография, импульсная полярография) |
|
Нестационарные (гальваностатические) методы | ||
|
I |
j = f(t) |
Хронопотенциометрия |
|
I + I sinwt |
|
Осциллографическая полярография с переменным током |
1.7 Избирательность определения
Рабочая область потенциалов для инверсионных электрохимических методов в водной среде находится в интервале от +1,5 до —2,5 В (от +0,2 до —2,5 В для ртутных электродов и от +1,5 до —0,7 В для графитовых электродов). В некомплексообразующих основных электролитах потенциалы пиков ряда элементов перекрываются или даже совпадают. Только в единичных случаях отличие в потенциалах пиков такое большое, что эти пики не оказывают друг на друга взаимного влияния. Относительно легко определить несколько металлов, если они находятся в растворе в одинаковых концентрациях. На практике, однако, часто требуется определить следовые количества одного вещества в присутствии большого избытка другого мешающего вещества, поэтому необходимо предварительно устранить его влияние.
Этого можно достигнуть, предварительно отделив мешающее вещество. Такой прием наиболее надежен, но на практике его применяют только в том случае, если для решения данной проблемы невозможно использовать другой, менее трудоемкий метод. Нежелательное влияние посторонних компонентов системы можно уменьшить и с помощью электрохимических способов: повышением избирательности накопления (например, применение потенциостата при определении металла в присутствии более электроотрицательного металла), выбором более селективного метода контроля процесса растворения (например, применение вольтамперометрии с переменной составляющей напряжения вместо классической вольтамперометрии или гальваностатического метода) или соответствующим подбором материала электрода.
В некоторых случаях можно сравнительно просто повысить избирательность при замене электролита: после стадии накопления выделенное вещество растворяется в чистом основном электролите или в другом пригодном растворе. Эти приемы до недавних пор были мало распространены, однако в настоящее время их применение расширяется [14], особенно в присутствии подходящих комплексообразующих реагентов [15].
1.8 Роль предварительного отделения в инверсионных электрохимических определениях
В ряде случаев, если определяемый компонент содержится в следовых концентрациях в очень сложных системах или же находится в присутствии очень большого избытка другого компонента (например, при анализе чистых реактивов, металлов и т. д.), предварительное отделение неизбежно. Для этой цели, как правило, применяют экстракционные и адсорбционные методы. Выбирая тот или иной метод для отделения, необходимо обращать особое внимание на то, чтобы компоненты системы не оказывали неблагоприятного влияния на исследуемую электролитическую реакцию (например, вследствие адсорбции поверхностью электрода избытка органических растворителей, или из-за появления следовых количеств поверхностно-активных веществ, выщелоченных из ионообменников, или в результате электрохимической реакции введенных реактивов и т. д.).
При экстракционном разделении обычно проводят реэкстракцию из органической фазы в водную или же органическая фаза минерализуется и растворяется в водном растворе перед непосредственным определением. Лишь в редких случаях, в основном при определении некоторых металлов, электролиз проводится прямо в неводной среде, в которой металл присутствует в виде ионного ассоциата. Этот прием перспективный, так как позволяет уменьшить число операций. К сожалению, имеется очень мало сведений по полярографии и вольтамперометрии комплексов металлов в неводной среде. [1]
1.9 Состояние и перспективы метода
В настоящее время в подавляющем большинстве инверсионных определений применяются процессы, сопровождаемые образованием амальгам металлов и металлических пленок (табл. 1.2, реакции 1 и 2). Другие процессы используются значительно реже. Как вытекает из вышеизложенного, электрохимические инверсионные методы являются очень подходящими для определения некоторых тяжелых металлов (Bi, In, Си, Tl, Pb, Cd, Sn, Zn) на ртутных электродах и некоторых благородных металлов (Ag, Hg) на твердых электродах. С помощью таких методов можно успешно определять указанные элементы в сплавах, чистых реактивах, водах, некоторых биологических материалах (в сыворотке крови, моче) и в некоторых продуктах питания.
Эти методы находят широкое применение при контроле загрязнений воды и воздуха. Например, классическая инверсионная вольтамперометрия часто используется для определения различных металлов в пресной и морской воде, а инверсионная вольтамперометрия с ртутным пленочным электродом на импрегнированной графитовой подложке — для контроля загрязнений воздуха [16].