Синтез и исследование комплексов рения (IV) с некоторыми аминокислотами
Преимущество механохимического метода синтеза заключается в его экологической частоте, а также в том, что в ряде случаев возможность упрощения технологической схемы процесса. Механообработка реагентов позволяет добиться смешения компонентов реакционной смеси практически на атомарном уровне и исключить использование в подавляющем большинстве случаев органических растворителей в синтезах химических соединений. Это позволяет избежать влияния органических растворителей на состав полученных полимеров и избавиться от проблемы утилизации растворителей, и создать более эффективные в экологическом отношении способы производства элементорганических полимеров и мономеров.
1.2 Некоторые свойства полиметаллоорганосилоксанов
Химические и физические свойства гетеросилоксанов черезвычайно разнообразны. Они зависят как от природы атома металла (его атомного радиуса, электроотрицательности, наличия и характера вакантных орбиталей, неподеленных электронных пар и свободных валентных электронов), так и от окружения атомов кремния и металла, составляющих гетеросилоксановую группировку. Эти факторы определяют распределение электронной плотности (полярность и порядок связей Si-O и O-M) в гетеросилоксановой группировке, а так же ее склонность к координации с нуклеофильными и электрофильными реагентами и к самоассоциации.
Большое влияние на свойства полимеров оказывает структура главных цепей молекул. Введение атомов металла в полимерную цепь может привести, к нарушению циклолинейной структуры силоксановой цепи. Поэтому значительное число работ посвящено изучению строения фрагментов, образование которых сопровождается введением того или иного металла.[1,42-43]
Андрианов предложил следующую структуру основных цепей молекул:
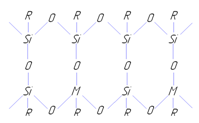
Полимеры состава [(RSiO1.5)mMOm/2] имеют незавершенную циклолинейную структуру и в зависимости от метода получения и условий синтеза способны переходить в нерастворимое состояние [8].
Так как полимеры содержат в своем составе 4-5% гидроксильных групп, то для них была предложена циклоразветвленная структура [12]
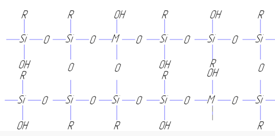
Такая структура хорошо объясняет свойства частиц по форме близкой к сферической, но степень завершенности реакции в исследуемых полимерах выше, чем следует из приведенной выше формулы.
Строение поллиметаллофенилсилоксанов зависит от состава и структуры исходного фенилсиликоната натрия [10].
Более высокая полярность связи O-M в группировках Si-O-M по сравнению с группой Si-O-Si в изоструктурных силоксанах обуславливает повышенную склонность гетеросилоксанов к гетеролитическим (ионным) реакциям, в частности, гидролизу. Когда электроотрицательность кремния и металла резко отличаются, гетеросилоксановая группировка Si-O-Mn гидролитически неустойчива. При действии воды она может либо обратимо диссоциировать на ионы Si-O- и M+ (при n=1 и M – щелочной металл), либо обратимо или необратимо гидролизоваться с первичным образованием фрагментов SiOH HOMn . По мнению авторов [44] механизм гидролиза связи M-O-Si заключается в образовании координационного переходного комплекса между молекулой воды и молекулой гидролизуемого вещества с последующим распадом по схемам:
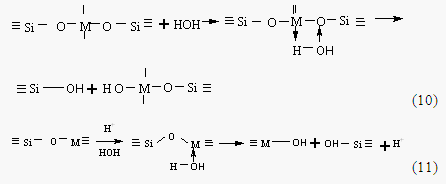
Важным свойством ПМОС является устойчивость к процессу термоокисления, которая зависит от многих факторов, а именно, от природы органических радикалов, связанных с кремнием, структуры макромолекул и типа металла [45-47]. При изучении устойчивости полимеров типа [(RSiO1.5)nMOn/2]x к действию 10%-ного раствора соляной кислоты было показано, что устойчивость в зависимости от природы металла и радикала у атома кремния уменьшается в ряду:
Ti> AL> Sn C6H5> C2H5
Систематическое исследование гидролитической устойчивости полиметаллоорганосилоксанов показало, что устойчивость полимеров возрастает при переходе от линейных структур к циклоразветвленным и сетчатым.
Характер влияния металла зависит от его электронного строения: к р- или d- типу он относится. С увеличением содержания в полимерах p-металлов термоокислительная деструкция ПМФС возрастает, снижаются температуры максимального развития процесса и значения кажущейся энергии активации. У полимеров, содержащих d-металлы, распад характеризуется более высокими значениями указанных величин, причем, наиболее устойчивы соединения с большим содержанием d-металла. В присутствии в цепи типичного комплексообразователя d-метала и с увеличением его содержания возрастает эффект межцепных взаимодействий, приводящих к образованию термически устойчивых надмолекулярных структур. В случае полимеров, содержащих в цепи р-металл, процесс термоокисления определяется основностью металла. Увеличение основности металла приводит к увеличению доли ионности связи во фрагментах Si-O-M, возрастают межцепные взаимодействия электростатической природы, что так же приводит к образованию устойчивых к термоокислению структур [48].
Введение атома металла в силоксановую цепь увеличивает термостойкость полимеров с метильными радикалами и несколько снижает устойчивость полимеров с фенильными радикалами по сравнению с ПОС. уменьшение устойчивости фенильных и метильных радикалов связано с индуктивным влиянием металла, под действием которого вызывается относительное уменьшение поляризации связи кремний – радикал, тогда как в случае метильного радикала полярность связи увеличивается [49].
При изучении термостабильности ПМОС линейного и циклолинейного строения было показано, что основная часть летучих продуктов, как и в случае полиорганосилоксанов составляет гексаметилциклотрисилоксан.
Повышение функциональности и координационной способности металла ведет к увеличению термостойкости, а возрастание основности и уменьшение значения энергии связи металл – кислород вызывает понижение термостойкости ПМОС [50].
2. Методика эксперимента
2.1 Синтез полифенилсилоксана (ПФС)
В трехгорлую колбу, снабженную механической мешалкой, обратным холодильником и капельной воронкой, помещали 800 мл воды и 400 мл диэтилового эфира. При охлаждении и энергичном перемешивании вводили в реакционную колбу 250 мл (1 моль) фенилтрихлорсилана в 250 мл диэтилового эфира так, чтобы не происходило сильного разогревания реакционной среды, охлаждали колбу льдом. После чего смесь перемешивали еще в течение 2 часов. В делительной воронке отделяли водный слой от эфирного, последний промывали водой до нейтральной реакции по универсальному индикатору и сушили над свежепрокаленным хлористым кальцием. Растворитель отгоняли при 80˚C/10 мм рт.ст., ПФС сушили до постоянного веса. Получили 127г ПФС, что составляет 98,4% от теоретического выхода.
2.2 Синтез мононатровой соли фенилсилантриола
К раствору 20г (0,16моль) ПФС в 83мл ацетона прибавляли 6,2г (0,16 моль) едкого натра и 8,3мл воды. Смесь нагревали на водяной бане при энергичном перемешивании до начала эндотермической реакции, при этом выпадал белый аморфный осадок. По окончании реакции смесь снова нагревалит до кипения и по каплям прибавляли воду до полного растворения осадка.
