Синтез нитробензойной кислоты
Очень важным производным бензойной кислоты является ее хлорангидрид — хлористый бензоил. Это жидкость с характерным запахом и сильным лакриматорным действием. Используется как бензоилирующий агент.
Пероксид бензоила используется как инициатор для реакций полимеризации, а также как отбеливающий агент для пищевых масел, жиров, муки.
Толуиловые кислоты. Метилбензойные кислоты называют толуиловыми кислотами. Они образуются при частичном окислении о-, м- и п-ксилолов. NN-Диэтил-м-толуилмид является эффективным репеллентом — препаратом, отпугивающим насекомых:
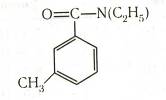
п-трет-Бутилбензойную кислоту получают в промышленных масштабах жидкофазным окислением трет-бутилтолуола в присутствии растворимой соли кобальта в качестве катализатора. Применяется в производстве полиэфирных смол.
Фенилуксусную кислоту получают из хлористого бензила через нитрил или через магнийорганические соединения. Это кристаллическое вещество с т. пл. 76 °С. Благодаря подвижности подородных атомов метиловой группы легко вступает в реакции конденсации. Эта кислота и ее эфиры применяются в парфюмерии.
СЕРНАЯ КИСЛОТА H2SO4— сильная двухосновная кислота. Безводная 100%-ная С. к. при комнатной температуре представляет собой в сильной степени ассоциированное соединение с длинными, образованными на счет водородных связей, цепевидными молекулами. При повышении температуры эти цепочки разрушаются
Физические и химические свойства серной кислоты. Безводная С. к.— бесцветная маслянистая жидкость, застывающая в кристаллич. массу при +10,37°. При 279,6С/700 мм безводная С. к. кипит с разложением до образования азеотрошюй смеси, содержащей 98,3% H2SO4 и 1,7% Н2О (эта смесь кипит при 338,8°). С. к. смешивается с водой и SO3 в любых соотношениях. Добавление воды к 100%-иой С. к. приводит к снижению температуры плавления (ок. 120 на 1моль воды), отвечающему образованию почти 2 частиц из каждой молекулы воды.
Теплота испарения составляет 122,1 ккал/кг 100%-ной С. к., теплота плавления 26,55 ккал/кг 100%-ной С. к.
Конц. С.к. — довольно сильный окислитель, особенно при нагревании. Она окисляет HJ и частично HВr (но не HCI) до свободных галогенов, уголь до С02, серу до SO2, а также многие металлы (Сu, Hg и р.)- Золото и платина устойчивы но отношению к С. к. при любых концентрациях и температурах. С. к. с концентрацией выше 93% не действует на железо. Разб. С. к. легко растворяет железо с выделением Н2. Окислительные свойства для разб. С. к. нехарактерны. Действуя как окислитель, С. к. обычно восстанавливается до SO2. Однако наиболее сильными восстановителями она может быть восстановлена до S и даже H2S. Копц. С. к. частично восстанавливается газообразным Н2, из-за чего и не может применяться для его сушки.
С. к. дает два ряда солей: средние — сульфаты, и кислые — бисульфаты, причем последние в твердом состоянии выделены лишь для немногих наиболее активных одновалентных металлов — Na, К и др
Получение. В современной заводской практике исходным веществом для получения С. к. служит сернистый газ. Процесс его переработки в С. к. может быть выражен суммарным стехиометрическим уравнением:
SO2 + 0,5О2 + пН2О = Н2SO4 + (п-1) Н2О
В промышленности этот процесс осуществляется посредством двух различных способов — контактного и нитрозного.
Сущность контактного метода состоит в том, что газообразный SО2, проходя «месте с кислородом или воздухом через катализатор, окисляется до SO3 по реакции:
SO2+0,5О2 = SO3 + 22,97 ккал/моль
Полученный SO3 растворяется в воде с образованием С. к.
Сущность нитрозного метода состоит в том, что обжиговый газ (после соответствующей очистки его от пыли) обрабатывается С. к., в которой растворены окислы азота. Сернистый ангидрид поглощается нитрозой, а затем окисляется окислами азота по реакции:
SO2 + N2O3 +H2O = Н2SO4 + 2NO
Образующаяся окись азота выделяется из нитрозы, в которой она плохо растворима, а затем частично окисляется кислородом в газовой фазе до двуокиси азота: полученная смесь NO и NO2 вновь поглощается серной кислотой и т. д. Окислы азота не расходуются, а возвращаются в производственный цикл. Но поскольку окислы азота не полностью поглощаются серной кислотой и частично уносятся отходящими газами, создаются невозвратимые потери.
Выпускается несколько сортов С. к., которые отличаются содержанием Н2SO4 и SO3 , а также составом и количеством примесей. Камерная кислота содержит (65% H2SO4, башенная — 75%, купоросное масло башенных систем — 90,5%, контактных — 92,5%. Олеум для нитрозы содержит 20,0% SO3, олеум для прочих целей — 18,5% SO3 .С. к. аккумуляторная (сорт А и Б) содержит 92—94% H2SO4, но своему качеству приближается к реактивной кислоте, содержащей 91,5 —95,6% H2SO4.
Конц. С. к.— башенную, купоросное масло и олеум — хранят в стальных нефутерованных баках. Для хранения к-ты более низкой концентрации стальные баки футеруют кислотоупорной керамикой. Олеум, купоросное масло, башенную к-ту и меланж перевозят в обычных стальных железнодорожных цистернах. Камерную и более слабую к-ту перевозят в стальных цистернах, покрытых внутри свинцом пли специальными кислотоупорными материалами (полиизобутиленом, винипластом и др.). Цистерны для перевозки олеума покрывают снаружи термоизоляцией во избежание замерзания олеума.
Техника безопасности Сернистый SO3 ангидрид вызывает раздражение кожи, слизистых оболочек носа, глаз и верхних дыхательных путей. Порог восприятия запаха 0,006—0,003 мг/л. При аварийном выделении газа пользуются фильтрующим противогазом. Допустимая концентрация SO2 0.01 мг/л. SO3 в свободном состоянии в воздухе не содержится: соединяясь с нарами воды, он образует туман, состоящий из мелких капель С. к. и затрудняющий дыхание. Допустимая концентрация в воздухе рабочей зоны — 0,001 мг/л. Окислы азота вызывают кашель, ощущение удушья и сухости в горле, рвоту и головную боль. Допустимая концентрация окислов азота в воздухе рабочей зоны 0,005 мг/л (в пересчете на N2O5). Допустимая концентрация в воздухе рабочей зоны производственных помещений селенистого ангидрида 0,001 мг/л. В случае отравления газами пострадавшему необходим свежий воздух, кислород, при сильных отравлениях — искусственное дыхание, медицинская помощь. Под действием С. к., меланжа и олеума кожа становится сначала белой, затем буроватой с покраснением. При этом окружающие ткани распухают. При попадании С. к. на кожу ее необходимо как можно скорее смыть сильной струей воды, обожженное место смочить 5%-ным раствором соды.
Применение. С. к. применяется в производстве минеральных удобрений, для получения разнообразных минеральных кислот и солей, всевозможных органических продуктов (в реакциях дегидратации (получение этилового эфира, сложных эфиров), гидратации (этиловый спирт из этилена), сульфирования (получение промежуточных продуктов в произ-ве красителей), алкилирования (получение изооктана, полиэтиленгликоля, капролактама н т.п.)), дымообразующих и взрывчатых веществ, в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности. Самым крупным потребителем С. к. является производствово минеральных удобрений — суперфосфата и сульфата аммония.
