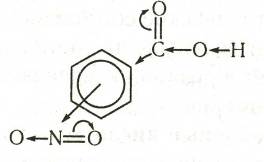
Синтез нитробензойной кислоты
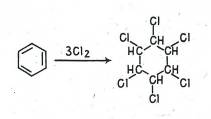
Бензол в отсутствие катализатора не реагирует с бромом и хлором, демонстрируя тем самым устойчивость трех двойных связей в его молекуле к действию электрофильных агентов. В то же время наличие последних подтверждается взаимодействием бензола с хлором при облучении, приводящим к образованию гексахлорциклогексана (гексахлоран):
Интересная реакция с участием двойных связей наблюдается при облучении бензола в жидкой фазе светом с длиной волны 253,7 нм. В этих условиях молекула бензола перестраивается, превращаясь в так называемые валентные изомеры.
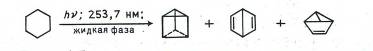
Таким образом, были получены три структуры из тех, которые предлагались ранее для бензола. Оказалось, что они резко отличаются по свойствам от последнего: легко окисляются (в том числе водным раствором перманганата), бурно реагируют с бромом.
В молекуле бензола сопряженные двойные связи в отличие от таковых в диенах и других сопряженных системах устойчивы к действию водорода в момент выделения. Однако в присутствии катализаторов гидрирования (платина, никель) бензол превращается в циклогексан:
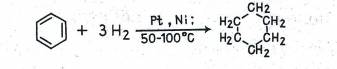
Эта реакция не только подтверждает строение бензола (наличие циклогексанового скелета и трех тг-связей), ее применяют также для оценки энергии его молекулы.
Ранее на примере алкенов и алкадиенов было показано, как для такой цели используют определение теплот гидрирования.
Измерение теплоты гидрирования бензола показало, что она составляет 206 кДж/моль, т. е. существенно меньше, чем утроенное значение теплоты гидрирования циклогексена (119 кДж/моль х 3 = 357 кДж/моль). Отсюда следует, что молекула бензола обладает меньшей энергией, чем можно было ожидать, от циклогексатриена. Разность указанных значений (357-206 кДж/моль) составляет ~ 150 кДж/моль и называется энергией стабилизации или резонанса.
Сходная картина наблюдается при сравнении значений теплот сгорания бензола, вычисленных по аддитивной схеме и найденных экспериментально. Соответствующая разность оказалась равной 159 кДж/моль. Таким образом, определение энергии стабилизации (резонанса) молекулы бензола двумя независимыми путями дало практически совпадающие результаты.
Замещенные одноосновные ароматические кислоты
Нитробензойные кислоты
При нитровании бензойной кислоты получается 78%-мета-, 20% орто- и 2% пара-нитробензойных кислот. Два последних изомера без примесей других изомеров получают окислением орто- и пара- нитротолуолов.
Нитробензойные кислоты обладают более сильными кислотными свойствами, чем бензойная кислота (К = 6,6·10-5): о-изомер — в 100 раз, м-изомер — в 4,7 раза и п-изомер — в 5,6 раза. Аналогичная закономерность наблюдается и в случае галогенозамещенных кислот.
Константы ионизации замещенных бензойных кислот
|
Заместитель |
Положение | ||
|
орто- |
мета- |
пара- | |
|
CH3 |
1.2·10-4 |
5.3·10-5 |
4.2·10-5 |
|
OH |
1.1·10-3 |
8.3·10-5 |
3.3·10-5 |
|
OCH3 |
8.0·10-5 |
8.2·10-5 |
3.4·10-5 |
|
Br |
1.4·10-3 |
1.5·10-4 |
1.0·10-4 |
|
Cl |
1.2·10-3 |
1.5·10-4 |
1.0·10-4 |
|
NO2 |
6.7·10-3 |
3.1·10-4 |
3.7·10-4 |
Увеличение силы кислот с электроноакцепторными заместителями в п- и м-положении объясняется увеличением подвижности кислотного протона благодаря ослаблению связи О—Н (уменьшение электронной плотности)
Уравнение Гаммета было впервые использовано при изучении диссоциации м- и п-замещенных бензойных кислот. Для этой реакционной серии значение р было приняторавным 1 и, следовательно, уравнение Гаммета имело вид lgК/К0= ρσгде К — константа скорости или константа равновесия для замещенного соединения; К0 — аналогичная константа для незамещенного соединения; σ — константа, характеризующая полярное влияние заместителя; ρ — константа, определяющая степень чувствительности реакционного центра к полярным эффектам. Константа σ зависит только от природы заместителя, а константа ρ — от характера реакции.
Соединения с различными заместителями, но с одним и тем же реакционным центром образуют реакционную серию.
σ-Константы некоторых заместителей приведены в таблице:
|
Заместитель |
σ |
Заместитель |
σ | ||
|
Мета- |
Пара- |
Мета- |
Пара- | ||
|
-H |
0 |
0 |
-I |
0.352 |
0.18 |
|
-CH3 |
-0.069 |
-0.17 |
-OH |
0.127 |
-0.37 |
|
-C2H5 |
-0.07 |
-0.151 |
-O |
-0.708 |
-0.519 |
|
-C(CH3)3 |
-0.1 |
-0.197 |
-OCH3 |
0.115 |
-0.268 |
|
-CF3 |
0.43 |
0.54 |
-NH2 |
-0.16 |
-0.66 |
|
-COOH |
0.355 |
0.265 |
-NHCOCH3 |
0.21 |
0 |
|
-COO- |
-0.1 |
0 |
-N(CH3)2 |
-0.211 |
-0.83 |
|
-COOC2H5 |
0.37 |
0.45 |
-N(CH3)3 |
0.88 |
0.82 |
|
-C0CH3 |
0.376 |
0.502 |
-NO2 |
0.71 |
0.778 |
|
-F |
0.337 |
0.062 |
-SO2 |
0.05 |
0.09 |
|
-CI |
0.373 |
0.227 |
-SO2NH2 |
0.46 |
0.57 |
|
-Br |
0.391 |
0.232 | |||
