Синтез этилового спирта
В светильном и коксовом газе находится 3-5% этилена; в некоторых газах нефтепереработки его содержание достигает 20%.
Этилен - очень реакционноспособное соединение; его химические свойства обусловлены главным образом межуглеродной двойной связью и проявляются в большой склонности к реакциям присоединения. Этилен - один из важнейших исходных продуктов синтеза органических соединений.
При действии хлора на этилен в органическом растворителе ( обычно в дихлорэтане) в присутствии металл.или хлорного железа гладко образуется дихлорэтан:
СН2=СН2 + Cl2 ® Cl2CH2CH2Cl
Дихлорэтан широко применяют как растворитель и сырье для получения винилхлорида и др. В присутствии АLСI3 этилен алкилирует бензол и образует этилбензол. В присутствии ионных катализаторов типа АLСI3 или ВF3 возможно алкилирование этиленом изопарафинов с образованием сильно разветвленных алканов, представляющих интерес в качестве авиационного топлива.
С НСI этилен при -30о дает этил хлористый, применяемый для этилирования, например, в производстве тетраэтилсвинца.
С хлоридами серы этилен образует дихлордиэтилсульфид (иприт) (СIСН2СН2)2S. Реакцией этилена с формальдегидом в уксусной кислоте в присутствии Н2SО4 можно получить ацетат триметиленгликоля его омылением - триметиленгликоль. Реакцией этилена с СО и Н2 можно получить пропионовый альдегид, а с СО2 - пропионовую кислоту.
К числу производств, основанных на использовании этилена и получивших широкое промышленное развитие, относятся в первую очередь его полимеризация, его окисление в окись этилена, гидратация в этиловый спирт.
Из общего количества используемого в различных странах этилена 25-40% расходуется на производство полиэтилена, 20-40% перерабатывается в спирт, до 25% идет на получение окиси этилена, »10% приходится на долю производства стирола (через этилбензол), примерно столько же на дихлорэтан и другие хлорпроизводные.
При содержании в воздухе около 0,1% этилена фрукты и овощи (особенно лимоны, виноград, помидоры) ускоренно созревают. В медицине этилен применяют для общего наркоза при хирургических операциях.
Этилен можно получать многими способами, в частности дегидратацией спирт, пропуская его пары над Al2O3 при 350о-400о. При этом образуется сравнительно чистый этилен. Метод применяется не только в лабораторной практике, но и в небольшом масштабе и в производстве. В странах, бедных нефтью, этилен иногда производят частичным гидрированием ацетилена при 180 - 320о над Рd - катализатором на силикагеле. Этилен можно также получать реакцией этана с избытком окиси углерода над Fе2О3 при 800 - 900о,образующаяся смесь этилена с СО пригодна для непосредственного получения пропионового альдегида.
Однако основные методы получения дешевого этилена в крупном масщтабе связаны с переработкой нефти и природного газа. Так, газы парофазного или жидкофазного крекинга нефтепродуктов при 700 - 800о содержат 17 - 20 % этилена. После разделения газов методами дробной абсорбции, глубокого охлаждения и ректификации под давлением выделяют этиленовую фракцию, с 90 - 95% этилена и примесью 1-3% пропилена, 1-4% метана и 3-6% этана.
В настоящее время основным источником низших олефинов является пиролиз углеводородного сырья, проводимый с целью производства этилена. Попутно при пиролизе получают другие ненасыщенные газообразные углеводороды - пропилен, бутены и бутадиен. Одновременно образуются жидкие продукты (смола пиролиза), которые содержат также ценные углеводороды, как изопрен, циклопентадиен, бензол, толуол, ксилолы и нафталин.
Основным сырьем процесса пиролиза с целью получения газах, газовые бензины прямой перегонки нефти, а также рафинад каталитического риформинга, остающийся после удаления ароматических углеводородов. В качестве сырья пиролиза применяют также средние и тяжелые нефтяные фракции и даже сырую нефть.
Процесс производства этилена и других олефинов из углеводородного сырья включает стадии пиролиза углеводородов, компримирования газа пиролиза, удаления тяжелых углеводородов, осушки, разделения (газофракционирование), удаление сероводорода, диоксида углерода и ацетилена. этилена являются этан, пропан и бутан, содержащиеся в попутных газах нефтедобычи и в нефтезаводских
Этиловый спирт - конечный продукт производства. Физические свойства этилового спирта описаны во введении данной работы. Рассмотрим теперь, что же представляет этиловый спирт по своим химическим свойствам. При взаимодействии этилового спирта с щелочными металлами образуются этилаты: 2С2Н5ОН + 2Nа®2С2Н5ОNа + Н2; водой этилаты омыляются до С2Н5ОН и NаОН. При действии на этиловый спирт кислот образуются сложные эфиры. Концентрированная H2SO4 образует с этиловым спиртом этилсерную кислоту
С2Н5ОН + Н2SО4 ® С2Н5НSО4 + Н2О;
При взаимодействии этилового спирта с уксусной кислотой в присутствии конц. серной кислоты или других катализаторов получается этилацетат:
С2Н5ОН + СН2СООН ® С2Н5ОСОСН3 + Н2О
При дегидрировании этилового спирта в присутствии катализаторов(серебро, медь) образуется ацетальдегид:
С2Н5ОН ® СН3СНО
Если пропускать пары этилового спирта над сложным катализатором при 380-400о нормальном давлении, происходит дегидратация и дегидрогенизация этилового спирта (способ С.В. Лебедева) с образованием бутадиена - 1,3 (дивинила):
2С2Н5ОН® СН2 = СН - СН = СН2 + 2Н2О + Н2
Нагреванием этилового спирта до 140о в присутствии Н2SО4 образуется диэтиловый эфир:
2C2Н5ОН ® (С2Н4)2О + Н2О
Над активированной окисью алюминия этиловый спирт дегидратируется до этилена:
С2Н5ОН® СН2=СН2 + Н2О
При каталитическом взаимодействии этилового спирта с аммиаком образуются моно-, ди- и триэтиламины.
Этиловый спирт - наркотик, возбуждающе действующий на организм. Длительное воздействие больших доз может вызвать тяжелые органические заболевания нервной системы, печени, сердечно-сосудистой системы, пищеварительного тракта и т.д.
Предельно-допустимая концентрация этилового спирта в воздухе рабочей зоны 1000 мг/м3 .
4 Расчётная часть
4.1 Материальные расчёты и составление материального баланса процесса
СН2 =СН2 + Н2О® С2Н5ОН
На образование 1кмоль спирта идёт 22,4 м3 этилена:
![]()
С учётом степени превращения на стадиях процесса:
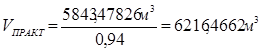
Вместе с этиленом будет подано этана в количестве:
![]()
Всего этан – этиленовой фракции:
2072,1554м3 +6216,4662м3 = 8288,6216 м3
Определим расход этилена:
G (C2H4) = (6216,4662 ּ 28)/22,4 = 7770,5828 кг
Определим расход этана:
G (C2H6) = (2072,1554 ּ 30)/22,4 = 2775,2081 кг
Всего этан – этиленовой фракции:
7770,5828 кг + 2775,2081 кг =12276,3кг = 10,5457909 тонн
Для получения 1 кмоль этанола требуется 1 кмоль воды. Определим расход воды для производства 12000 кг этилового спирта:
G (Н2O) = 18 ּ 12000 / 46 = 4695,6522 кг
