Синтез этилового спирта
Побочных продуктов с учётом степени превращения образуется:
![]()
Таблица 1. Материальный баланс.
|
Приход |
кг |
Расход |
кг |
|
Этиленовая фракция Вода |
10545,7909 4695,6522 |
Этанол Этан Побочные продукты |
12000 2775,2081 466,235 |
|
Итого |
15241,4431 |
Итого |
15241,4431 |
4.2 Тепловые расчёты и составление теплового баланса процесса
Тепловой баланс процесса рассчитываем на основании уравнения:
![]()
где G – количество вещества, с – средняя теплоемкость этого вещества, t – температура, отсчитанная от какой-либо точки (обычно от 00С).
Рассчитываем количество теплоты, вносимое водой:
![]()
Рассчитывает количество теплоты, вносимое этиленовой фракцией:
Теплоёмкость этиленовой фракции рассчитываем по уравнению:
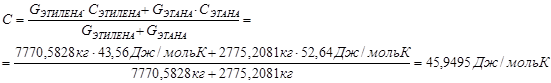
![]()
Определим количество теплоты, уносимое этаном: t=2200С
Q (С2H6) = 2775,2081 ּ (5,75 + 175,11 ּ 10-3 ּ 493 - 57,85 ּ 10-6 ּ 4932) ּ (320-220) =17321,48253 кДж/час
Определим количества теплоты, уносимо этанолом:
Q (C2H5OH) = G ּ с ּ t, t=2200С
G (C2H5OH) = 16000 кг/час
с= (19,07 + 212,7 ּ 10-3 ּ 493 – 108,6 ּ 10-6 ּ 4932) = 97,536 Дж/мольּК
Q (C2H5OH) = G ּ с ּ t = 12000 ּ 97,536 ּ (300-220) = 93634,53946 кДж/час
Количество теплоты, уносимое из реактора с помощью холодильников:
Qп =Q (H2O) + Q (эт.фр.) – Q (C2H6)-Q (C2H5OH)=77805,68913+ 106606,1794-
-17321,48253- 93634,53946=73455,84654 кДж/час
Расход воды в холодильниках:
с (Н2О) = 33,61 Дж/моль ּ К
G(воды в холодильниках) = Qп/(с(воды) ּ (tкон – tнач)) = 73455,84654 ּ 1000/33,61 ּ (300-220) = =27319,19315 кг/час
Таблица 2. Тепловой баланс
|
Приход |
кДж |
Расход |
кДж |
|
Этиленовая фракция Вода |
106606,1794 77805,68913 |
Этанол Этан Вода в холодильниках |
93634,53946 17321,48253 73455,84654 |
|
Итого |
184411,8685 |
Итого |
184411,8685 |
4.3 Термодинамический расчёт
CH2 = CH2(г) + H2O(пар) < = >C2H5OH(г) T=493K
Зависимость удельной изобарной теплоёмкости от температуры выражается уравнениями:
![]() – для органических веществ
– для органических веществ
![]() – для неорганических веществ
– для неорганических веществ
Изменение удельной изобарной теплоёмкости считается по уравнению:
![]()
Изменение удельной изобарной теплоёмкости для данной реакции:
![]()
Δа=19,07-4,196=14,874
Δb=(212,7-154,59) ּ 10-3=58,11 ּ 10-3
Δc=(-108,6+81,09) ּ10-6=-27,51 ּ10-6
![]()
Энтальпия реакции при данной температуре рассчитывается по формуле:
![]()
![]() =
=
= - 45,74 кДж/моль
![]() = - 45,74 кДж/моль + ∫((14,874+58,11 ּ 10-3Т - 27,51 ּ10-6Т2) –
= - 45,74 кДж/моль + ∫((14,874+58,11 ּ 10-3Т - 27,51 ּ10-6Т2) –
- (30,00+10,71 ּ 10-3Т + 0,33 ּ 105Т-2))dT Дж/моль = - 45,74 кДж/моль +14,874 ּ (493- -298) + 0,5 ּ 58,11 ּ 10-3 ּ (4932-2982) - 0,33 ּ 27,51 ּ10-6(4933-2983) – (30 ּ (493-298) + 0,5 ּ 10,71 ּ 10-3(4932-2982) – 0,33 ּ 105(493-1-298-1)= -45,74 кДж/моль + 1,785 кДж/моль= - 43,955 кДж/моль
Энтропию реакции при 493 К рассчитаем по уравнению:
![]()
![]()
![]()
![]()
![]() -126,14 +
-126,14 + ![]() ((14,874 ּ Т-1 +58,11 ּ 10-3 - 27,51 ּ10-6Т) – (30 ּТ-1 + 10,71 ּ 10-3 + +0,33 ּ 105Т-3)dT = - 126,14 + 14,874ln(493-298) +58,11 ּ 10-3(493-298) – 0.5 ּ 27,51 ּ10-6 (4932-2982) – 30 ּ ln(493-298) - 10,71 ּ 10-3(4932-2982) – 0.5 ּ 0,33 ּ 105(493-2-298-2) =
((14,874 ּ Т-1 +58,11 ּ 10-3 - 27,51 ּ10-6Т) – (30 ּТ-1 + 10,71 ּ 10-3 + +0,33 ּ 105Т-3)dT = - 126,14 + 14,874ln(493-298) +58,11 ּ 10-3(493-298) – 0.5 ּ 27,51 ּ10-6 (4932-2982) – 30 ּ ln(493-298) - 10,71 ּ 10-3(4932-2982) – 0.5 ּ 0,33 ּ 105(493-2-298-2) =
=-198,66 Дж/моль ּ К
Энергия Гиббса для реакции при 493 К вычисляется по уравнению:
![]()
![]()
Так как реакция является обратимой, найдём значение константы равновесия:
![]()
5 Отходы и их обезвреживание
Процесс производства синтетического этилового спирта методом прямой гидратации этилена связан с применением и образованием токсичных, взрывоопасных и пожароопасных веществ.
Для уменьшения и предотвращения вредных выбросов в атмосферу газов, содержащих токсичные углеводороды,(этилен, диэтиловый эфир, ацетальдегид и др.) имеются следующие возможности:
· строгое соблюдение технологического режима (при этом снижается количество выбросов через предохранительные клапаны и воздушники, уменьшаются частота остановок и связанное с ними сбрасывание газов);
· монтаж и эксплуатация оборудования в соответствии с правилами (это предупреждает газовые выбросы через неплотности).
