Сравнительный анализ методы получения синтез-газа
Оксид ZrO2 в катализаторе Ni/ZrO2-MgO стабилизирует состояние никеля на носителе MgO [23]. Температура восстановления NiO повышается с ростом количества MgO. Так, катализатор Ni/ZrO2 без MgO при 800 °С очень мало активен, добавление же всего 1% MgO приводит к 90%-ной конверсии метана, что близко к равновесию.
Высокоэффективными катализаторами сухой конверсии метана являются Ni-содержащие перовскиты LaNixFe(1─ x)О3, конверсия СН4 и СО2 составляет 97.5%, выход СО равен 97,1% при 800 °С [24]. В условиях катализа смешанная перовскитная структура разрушается, но при составе перовскита х < 0,5 катализаторы могут быть регенерированы путем прокаливания. При 0,3 < x < 0,8 образуются сплавы никеля с железом разного состава. Предполагается, что образование сплава предотвращает отравление катализатора углеродом благодаря торможению диффузии углерода сквозь частицу Ni.
Каталитическая активность и коксоустойчивость перовскитов состава La1─ xSrxNiO3 (x = 0, 0,1) и La2 ─ xSrxNiO3 (x = 0,1) при 600─900 °С и атмосферном давлении зависит от типа перовскита и степени замещения
Sr [24]. Так, LaNiO3 показывает высокую каталитическую активность, а La2NiO4 ─ совершенно неактивен. Среди стронций-замещенных катализаторов La0,9Sr0,1NiO3 и La1,8Sr0,2NiO4 имеют максимальную активность.
Начальная активность катализаторов этого типа растет со временем по мере их работы, достигая стационарного состояния. Рентгенофазовый анализ отработанных катализаторов показывает, что в условиях реакции катализаторы превращаются в смесь фаз La2O2CO3 и SrCO3 с высокодисперсным Ni. Такое превращение может быть вызвано удалением решеточного кислорода при замещении, ускоряемом в восстановительной атмосфере при CH4/CO2 = 1. Предположительно, высокая активность обусловлена двумя центрами: La2O3 служит для адсорбции CO2, Ni ─ для активации CH4.
Перовскитные катализаторы Ni/Ca0,8Sr0,2TiO3 и Ni/BaTiO3, приготовленные методом твердофазной кристаллизации, были испытаны в сухом риформинге метана. В условиях катализа образуется металлический Ni, который равномерно распределяется в решетке перовскитной матрицы. Отмечено, что внедрение Ni в решетку BaTiO3 происходит легче, чем в решетку Ca0,8Sr0,2TiO3. Высокая дисперсность никеля приводит к высокой активности и коксоустойчивости катализатора, причем снижение углеобразования частично обязано присутствию щелочноземельных металлов. Подвижный кислород в решетке перовскита также способствует удалению углерода.
Изучено влияние добавок Mo и W на каталитические свойства системы Ni/Al2O3 [24]. Никелевый катализатор, легированный малыми добавками Мо, дезактивируется, хотя при низких степенях легирования углерода на поверхности катализатора не наблюдалось. Напротив, катализатор, легированный W, не дезактивируется, углерода на поверхности значительно меньше, чем на непромотированном катализаторе. Ингибирование углеотложения объясняется образованием карбидов Мо и
W, активных в сухой конверсии метана. По-видимому, карбидные центры формируются вблизи никелевых центров в Ni/Al2O3, промотированном Mo/W. Эти центры обеспечивают диссоциацию СО2 и увеличивают на каталитической поверхности количество кислорода в атомарном состоянии, доступное для реакции с поверхностным углеродом.
4.5 Технология конверсии метана
Способ паровой конверсии в трубчатых печах применяется для получения синтез-газа, используемого для производства водорода, аммиака и метанола. Для синтеза метанола паровая конверсия обладает существенным недостатком ─ получают газ с избыточным содержанием водорода, а переработка таких газов приводит к увеличению затрат на сжатие. Кроме того, избыточный водород ─ балласт в процессе синтеза, и его приходится отводить с продувочными газами. Но, несмотря на это, процесс паровой конверсии все еще считается наиболее экономически эффективным вариантом для крупнотоннажных (750 тыс. т/год) установок производства метанола, имеющих одну технологическую линию и рассчитанных на использование в качестве сырья газа по низкой или умеренной цене.
В России наиболее широко распространен процесс паровой конверсии метана. Процесс идет в несколько стадий: подготовка сырья, конверсии, утилизации тепла, очистки газов от CO2. Сырье очищают по необходимости.
Исходный метан сжимают турбокомпрессором 1 до 2 ─ 3 МПа (см. рис. 15) и смешивают с необходимым количеством водяного пара и CO2. Смесь подогревают в теплообменнике 2 до 400 оС частично охлажденным конвертированным газом и подают в смеситель конвертора 6, куда поступает предварительно приготовленная смесь O2 с равным объемом водяного пара. Конвертор охлаждается кипящим в рубашке конденсатом; при этом генерируется пар с давлением 2 ─ 3 МПа, который отделяют в паросборнике 5. Тепло горячего конвертированного газа, выходящего из конвертора при 800 ─ 900 oC, используют в котле-утилизаторе для получения пара высокого давления, направляемого затем в линию пара соответствующего давления или используемого для привода турбокомпрессора. Тепло частично охлажденного газа утилизируют для предварительного подогревания смеси в теплообменнике 2 и в теплообменнике 3 для нагревания водного конденсата, питающего котел-утилизатор. Окончательное охлаждение осуществляют в скруббере 7 водой, циркулирующей через холодильник 8. При этом на выходе газ содержит смесь газов следующего состава:
CO ─ 15 – 45% (об.)
H2 ─ 40-75% (об.)
CO2 ─ 8-15% (об.)
CH4 ─ 0,5% (об.)
N2 и Ar ─ 0,5-1% (об.)
Очищают от CO2 через абсорбцию под давлением, хемосорбцию водным раствором моноэтаноламина или карбоната калия.
Наверх газ поступает в абсорбер 9, где поглощается CO2, а очищенный газ направляется к потребителю. Насыщенный абсорбент подогревается в теплообменнике 10 горячим регенерированным раствором и направляется в десорбер 11, с низа которого абсорбент направляется через т/о 10 вновь на поглощение CO2 в абсорбер 9. CO2 с верха 11 компримируют до соответствующего давления и возвращают на конверсию, смешивая перед т/о 2 с природным газом и водяным паром.
Расход на 1 м3 синтез-газа составляет:
Природный газ ─ 0,35 – 0,40 м3,
Технический O2 ─ 0,2 м3,
и в зависимости от применяемого
давления и добавки CO2 ≈ 0,2 - 0,8 кг водяного пара.
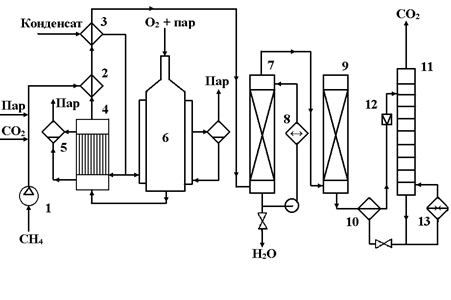
Рис. 15. Технологическая схема окислительной конверсии природного газа при высоком давлении
1 – турбокомпрессор; 2, 3, 10 – теплообменники; 4 – котел-утилизатор; 5 – паросборники; 6 – конвертор; 7 скруббер; 8 – холодильник; 9 – абсорбер; 11 – десорбер; 12 – дроссельный вентиль; 13 – кипятильник.
За рубежом развитие процессов паровой и углекислотной конверсии метана направлено несколько в другую сторону. На рис. 16 показаны принципиальные технологические схемы конверсии метана с паром для получения водорода и комбинированного парового/углекислотного риформинга для производства синтез-газа.
