Сравнительный анализ методы получения синтез-газа
на Ni/C, Ni/SiO2, Ni/TiO2 и Ni/MgO, а также на нанесенных Pt-катализаторах [12] было получено кинетическое уравнение:
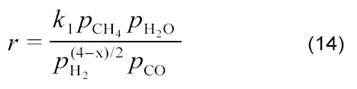 |
По мнению авторов [12], оно соответствует схеме:
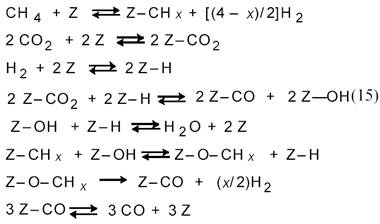 |
Для процесса на катализаторе Ni/Al2O3 было получено уравнение:
r = kp1/2 (16)
Существует сводка данных (взятых из более 60 статей) по исследованию кинетики углекислотной конверсии метана. Ниже дана краткая оценка этих данных.
Значения энергии активации Еа изменяются в интервале:
· по расходованию CH4 и CO2 соответственно от 30 до 350 кДж/моль и от 35 до 130 кДж/моль,
· по выходу CO и H2 соответственно от 38 до 218 кДж/моль и от 38 до 250 кДж/моль.
Наиболее выпадающие значения ЕСН4 относятся к реакции на Re/Al2O3 350 кДж/моль) и Pt (73 кДж/моль). Некоторые исследователи считают, что из числа достоверных данных следует также исключить значения энергии активации для реакции на Pb/MgO, т.к. EСО > EН2, причем ЕСО = 921 кДж/моль. Большинство остальных данных для Ni-катализаторов находятся вблизи значения 239 ± 20 кДж/моль, которое довольно близко к энергии активации диссоциации СН4 на Ni(110) и Ni(111): 233 ± 27 и 221 ± 20 кДж/моль, соответственно. Для катализа с участием благородных металлов Еа ближе к 314─377 кДж/моль.
На кажущиеся значения энергии активации углекислотной конверсии метана сильно влияет реакция (6), что отражается, по-видимому, в увеличении ЕСН4 с ростом объемной скорости. При этом снижается конверсия и влияние обратной реакции (гидрирование СО в СН4)становится менее значительным.
Каталитическая активность при 450 °С (экстраполяция), выраженная через число оборотов реакции tn, изменяется в интервале от 0,1 до 1,0.
Большие значения tn получены для Ru/TiO2 (4,3.7,2), Ru/Al2O3 (1,5─4,3), Rh/VOx/SiO2 [4]. Для кристалликов Rh на носителе получен следующий ряд tn: ZrO2 > TiO2 ≥ Al2O3 > La2O3 = SiO2 > MgO. Этот ряд совпадает с рядом: TiO2 > Al2O3 > SiO2 и не совпадает с рядами: Al2O3 > La2O3 > CeO2 > MgO > TiO2 и MgO > TiO2 ≈ Al2O3 > SiO2 [13].
Было установлено, что число оборотов реакции не зависит от природы носителя: ZrO2 ≈ TiO2 ≈ Al2O3 ≈ SiO2. Такие противоречия могут быть объяснены влиянием обратной реакции, измерениями при разных объемных скоростях или неправильностью экстраполяций. Для нанесенных Ni-катализаторов получен следующий ряд tn:TiO2 > Al2O3 ≈ SiO2 ≈ MgO.
В подавляющем числе исследований установлено, что скорость углекислотной конверсии метана пропорциональна давлению СН4 в первой степени, в то время как величина ρCOn входит в кинетические уравнения, приведенные в разных работах, в числитель и знаменатель с показателем степени n от 0 до 2. Это указывает на то, что взаимодействие метана с катализатором является лимитирующей стадией.
Константы скорости взаимодействия СН4 и СО2 с единичным Ni-центром на Ni/TiO2 были измерены при 420 °С. С повышением температуры восстановления катализатора способность к диссоциации СН4 растет, а диссоциации СО2 не изменяется.
Положительный кинетический изотопный эффект (КИЭ) kCH4/kCD4, наблюдавшийся в процессе на Ni/γ-Al2O3, Ni/SiO2, Rh/SiO2 , Ni/La2O3 [13], также указывает на то, что стадия активации метана является лимитирующей, а диссоциация СО2 происходит легко. Для реакций на Ni/Al2O3 и Ni/La2O3 величина КИЭ растет с повышением температуры, причем в случае Ni/La2O3 КИЭ значительно выше, чем в процессе на Ni/Al2O3.
Исследование кинетики углекислотной конверсии метана на Ni/SiO2 при 700 0С и атмосферном давлении [13] позволило получить следующие данные: реакция первого порядка по ρСО2 и по ρН2, с ростом ρСН4 скорость реакции быстро увеличивается и достигает насыщения.
Для описания кинетики предложена схема
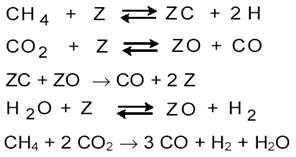 |
Лимитирующей стадией является поверхностное взаимодействие адсорбированных углерода и кислорода. По данным [13], кинетика углекислотной конверсии метана сильно зависит от обратной реакции ─ гидрирования CO:
Энергия активации реакции по расходованию метана (ECH4) растет в ряду Ru/TiO2, Ru/Al2O3, Ru/C: 76,4; 107,4; 107,6 кДж/моль, соответственно. Такая же закономерность наблюдается для ECO2: 71,6; 75,4; 86,2 кДж/моль, что отвечает эффекту сильного взаимодействия металл-носитель.
EH2 = 17,1; 18,0; 20,6 кДж/моль, соответственно, была всегда больше ECO: 97,1; 125,2; 111,3 кДж/моль.
Для реакции на сульфидных катализаторах MoS2 и WS2 при 600 °С получено следующее кинетическое уравнение:
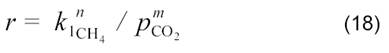 |
которое отличается от уравнений (14, 16, 17) для реакции на нанесенных металлических катализаторах. Расхождения объясняются большой адсорбцией СО2 и малой адсорбцией СН4. Наличие СО2 на поверхности подавляет разложение метана.
Для реакции на оксидно-марганцевых катализаторах в наших работах [14] было получено кинетическое уравнение
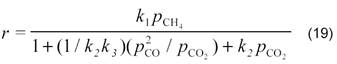 |
В случае малых конверсий уравнение имеет более простой вид:
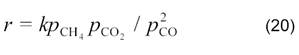 |
Практически все исследователи отмечают, что конверсия СО водяным паром протекает с большими скоростями, чем углекислотная конверсия СО2.
4.3 Механизм конверсии смеси CH4 + CO2
В большинстве предлагаемых механизмов углекислотной конверсии метана рассматривается диссоциативная адсорбция метана и СО отличающаяся от схемы (11) отсутствием стадии взаимодействия СНх с водой [15]. Предполагается последовательная диссоциация СН4 на поверхности образованием частиц СНх и С и их взаимодействие адсорбированным атомом О, а не с водой. Эти процессы отражает схема:
