Сравнительный анализ методы получения синтез-газа
Методом температурно-программированного гидрирования после завершения реакции на Ni/MgO были обнаружены две формы углерода: аморфный α-С, гидрирующийся при 270─420 °С и β-С, гидрирующийся выше 600 °С, по-видимому, это графит. Углерод образуется преимущественно на малых частицах никеля.
Проведение температурно-программированного процесса взаимодействия СО и СН4 на катализаторах Ni0,03Mg0,97O, 3%Ni/MgO и 3%Ni/Al2O3 позволило выявить, что углерод образуется как при диспропорционировании СО, так и при диссоциации метана [18]. При
этом происходит быстрое окисление СНх на Ni под действием СО2. На всех трех изученных катализаторах температура пика взаимодействия С+СО2 одна и та же ─ 550 °С), что указывает на отсутствие взаимодействия между катализатором и осажденным углеродом. На восстановленном катализаторе Ni0,03Mg0,97O реакция между СО2 и Ni протекает при температуре на 40 °С ниже, чем на остальных катализаторах. Авторы [18]
приходят к выводу, что возможны два маршрута активации СО2:
1) на носителе вблизи границы с Ni и 2) на частицах Ni.
Первый маршрут более благоприятен для ингибирования углеобразования.
В опытах со смесями 13СН4 + 12СО2 на катализаторе Ni/CaO-Al2O3 также было установлено, что углерод образуется как из СО, так и из СН4 [38]. Высокотемпературный пик поглощения Н2 в ТПР-экспериментах (450─600 °С) приписан спилловеру водорода с Ni на носитель.
Квантово-механический расчет реакции СО2+СН4 на Cu(111), Ni(111), Pd(111), Pt(111), Rh(111), Ru(111), Ir(111) и Fe(111) методом UBI─QEP (unity bond index ─ quantum exponential potential) [18] показал, что лимитирующими стадиями являются как диссоциация СН4, так и диссоциация СО2, причем оба процесса ускоряют друг друга. Рассмотрев 84 возможных реакции на поверхности, авторы пришли к следующей более вероятной схеме:
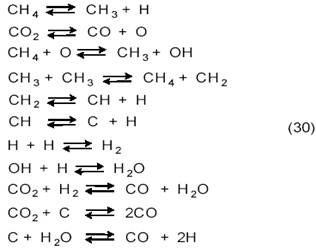
Ряд каталитической активности, по их расчетам, примерно соответствует экспериментальным данным:
Fe > Ni > Rh > Ru > Ir > Pd > Pt > Cu.
Однако для практики Ni предпочтительнее Fe, потому что никель менее подвержен коксоотложению, а Ru лучше Rh, поскольку рутений дешевле.
Промежуточное образование карбонатов в углекислотной конверсии метана на оксидных катализаторах было доказано в наших работах [14]. Согласно кинетическим данным и методу термодесорбции и рентгенофазового анализа на нанесенных оксидно-марганцевых катализаторах процесс протекает по механизму
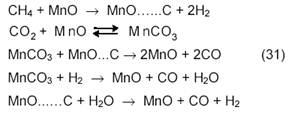
Таким образом, продукт реакции ─ СО образуется в результате восстановительного разложения карбоната при его взаимодействии с углеродом (или карбидом, или СНх) или с Н2.
До сих пор не был рассмотрен вопрос о возможных гомогенных стадиях в углекислотной конверсии метана. Между тем, появились сведения о гетерогенно-гомогенном механизме другой эндотермической реакции, а именно, паровой конверсии СН4 в синтез-газ (1). Авторы [19, 20] связали наблюдаемое ими увеличение скорости реакции при уменьшении навески Ni-катализатора ГИАП-16 с реализацией гетерогенно-гомогенного механизма с вылетом в объем промежуточных частиц, например метильных радикалов. Кинетика и механизм реакций (1) и (3) близки. Поэтому не исключено наличие гомогенных стадий и в конверсии СН4+СО2. Также был обнаружен аналогичный эффект для реакции (3) ─ небольшой рост конверсии с уменьшением навески Ni-Cr/MgO-катализатора. Однако величина эффекта не настолько велика, чтобы принять его как доказательство гетерогенно-гомогенного механизма. Таким образом, совокупность данных большого числа работ доказывает существование двух основных механизмов реакции СН4+СО2:
1) диссоциация СН4 и СО2 и последующее взаимодействие атомарных фрагментов С, Н и О на массивных металлических катализаторах или на металлах, нанесенных на инертные носители, и
2) диссоциация СН4 и взаимодействие фрагментов С или СHx с СО2 или с СО32─ на металлах, нанесенных на основные носители. В последнем случае взаимодействие облегчается в присутствии добавок оксидов переходных металлов, участвующих в восстановлении CO2.
4.4 Катализаторы углекислотной конверсии метана
Нанесенные никелевые катализаторы.
Наибольшую активность в углекислотной конверсии СН4 проявляют нанесенные никелевые катализаторы. Однако они имеют существенный ─ потеря активности при закоксовывании. Для борьбы с этим явлением применяются разные приемы. Так, в процессе SPARG, разработанном фирмой «Topsoe», углеотложение на никеле подавляется путем пассивации серой. Считают, что сера препятствует образованию больших ансамблей углерода и таким образом ингибирует процесс углеотложения сильнее, чем реакцию (3).
Наименее подвержены влиянию кокса катализаторы, в которых никель нанесен на основные носители. Так, если катализатор Ni/Al2O3 обладает наибольшей активностью в начальный период работы, то катализаторы Ni/MgO, Ni/CaO, Ni/MnO, Ni/ZrO2 превосходят его по эксплуатационным качествам, проявляя устойчивость в отношении коксообразования. Отмечается [10], что углеотложение подавляется, если металл нанесен на носитель с высокой основностью по Льюису. На таких оксидах, как СaO, MgO, TiO2, адсорбированный диоксид углерода реагирует с углеродом по реакции, соответствующей обратной реакции Будуара (8):
![]()
Применяют также щелочные добавки к таким носителям, как Al2O3. По-видимому, образование не слишком стабильных карбонатов облегчает их взаимодействие с углеродом.
Несомненный интерес представляет цикл работ японских исследователей по углекислотной конверсии метана на никелевых катализаторах [11─24]. Методом соосаждения солей Ni и Mg была получена система Ni0,03 Mg0,97O, представляющая собой твердый раствор NiO и MgO, которая оказалась близкой по активности к нанесенному катализатору примерно такого же состава 3%NiO/MgO, но со значительно более высокой коксоустойчивостью. Стабильность обоих катализаторов много выше, чем Ni/SiO2 и Ni/Al2O3.
В условиях низких температур (500 °С) отложение кокса на катализаторе Ni0,03Mg0,97O не наблюдается. При 650 °С активность катализатора не снижается в течение 3000 ч. При более высокой температуре (700─900 °С) на нем также практически не обнаруживается
кокс. В условиях катализа весь никель восстанавливается до металлического состояния, при этом металл выделяется в виде высокодисперсных частиц. Каталитическая активность в конверсии СН4 + СО2 коррелирует с количеством наиболее слабо связанного аморфного α-углерода.
По мнению авторов [11], дезактивация катализатора вызвана не столько углеобразованием, сколько реокислением Ni до NiO. Маленькие частицы Ni, образующиеся в твердом растворе Ni0,03Mg0,97O, восстанавливают СО2 до СО, при этом окисленные частицы NiO в условиях реакции снова восстанавливаются до металлического Ni.
