Теоретические основы электрохимической коррозии
3 Условия возникновения коррозионного процесса
Коррозия металлов представляет собой частный случай неравновесных электродных процессов; в то же время ей свойственны некоторые особенности, отличающие ее от других неравновесных электродных процессов. Для протекания коррозионного процесса совсем не обязательно наложение внешнего тока и тем не менее растворение металла в условиях коррозии совершается со скоростями, сравнимыми с теми, какие наблюдаются при растворении металлических анодов в промышленных электролизерах.
Если кусок какого-либо металла М приведен в контакт с водным раствором его соли МА, то через некоторое время на границе между металлом и раствором устанавливается значение потенциала, которое в дальнейшем будет сохраняться почти неизменным. Эта постоянная, или почти постоянная, величина может отвечать установившемуся равновесию между металлом и раствором или стационарности электродного процесса. Какой из этих двух случаев реализуется в действительности, определяется, в первую очередь, самой величиной электродного потенциала. Если термодинамический электродный потенциал металла имеет величину, при которой в данных конкретных условиях исключено протекание всех других процессов, (кроме обмена металлическими ионами между металлом и раствором), то установившаяся величина потенциала отвечает его равновесному значению в данных условиях. Скорость переходов ионов металла в двух противоположных направлениях выравнивается при достижении состояния равновесия и становится равной току обмена (уравнение 1 ), а установившееся значение потенциала отвечает его термодинамической величине.
![]() (1)
(1)
Примером таких систем может служить серебро, опущенное в раствор нитрата серебра.
Положение существенно меняется, если термодинамический электродный потенциал металла имеет величину, при которой наряду с ионизацией и разрядом ионов металла возможен хотя бы один дополнительный электродный процесс. В этом случае заряды через границу раздела между металлом и раствором переносятся уже не одним, а двумя сортами частиц. Установившееся постоянное значение потенциала не обязательно свидетельствует о достижении равновесного состояния. Оно указывает лишь на то, что суммарное число зарядов, переходящих через границу в одном направлении, равно суммарному числу зарядов, пересекающих ее в обратном направлении (уравнение 2):
![]() (2)
(2)
Если предположить, что дополнительным электродным процессом будет выделение и ионизация водорода, так называемая коррозия с водородной деполяризацией, то вместо уравнения 2 можно написать уравнение 3:
![]() , (3)
, (3)
где индекс М относится к металлу, а индекс Н — к водороду.
Когда скорости всех частных процессов сравнимы и ни одной из них в уравнении 3 пренебречь нельзя, тогда установившаяся величина потенциала не отвечает ни потенциалу металлического электрода первого рода (или металлического электрода второго рода, что возможно, если металл покрыт слоем его труднорастворимого соединения), ни потенциалу водородного электрода. Это будет некоторая компромиссная величина, зависящая от соотношения скоростей всех частных реакций (рисунок 1).
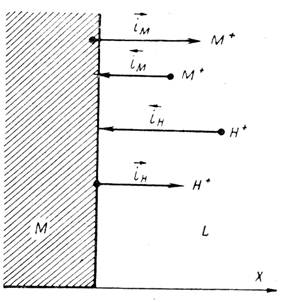
Рисунок 1 - Схема установления компромиссного или стационарного коррозионного потенциала при сравнимых скоростях катодной и анодной реакций:
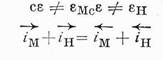
Однако могут быть такие случаи, когда потенциал данного электрода не очень сильно отличается или от потенциала водородного электрода, или от потенциала соответствующего металлического электрода. Действительно, хотя частные токи в уравнении 3 не отвечают токам обмена в состоянии равновесия, они все же должны изменяться параллельно с величинами последних. Поэтому, если ток обмена металла i0M значительно больше тока обмена водорода i0Н, то с известным приближением можно допустить, что
![]() и
и ![]() .
.
Тогда вместо уравнения 3 можно написать в виде уравнения 4:
![]() (4)
(4)
Следовательно, поведение корродирующего электрода отвечает поведению обратимого металлического электрода, а установившееся значение компромиссного потенциала близко к равновесному потенциалу соответствующего металлического электрода и должно изменяться с концентрацией ионов металла в соответствии с формулой Нернста.
Изменение рН раствора не влияет при этом заметно на величину стационарного потенциала. Таким образом, здесь стационарный потенциал коррозии сε приводится к обратимому потенциалу металла Мεr (уравнение 5):
сε ≈ Мεr (5)
В качестве примеров таких систем можно привести разложение амальгам и электрохимическое растворение цинка.
Напротив, если ток обмена водорода значительно больше тока обмена металла, то
![]() ,
,
![]()
и, с некоторым приближением, можно получить уравнение 6:
![]() (6)
(6)
Теперь уже компромиссный потенциал близок к потенциалу водородного электрода в данных условиях. Его величина закономерно изменяется с рН и почти не зависит от концентрации ионов металла. Таким образом, здесь стационарный потенциал приводится к потенциалу водородного электрода (уравнение 7):
сε = Нεr (7)
Коррозия железа в слабокислых растворах служит примером подобного рода систем.
Необходимым условием электрохимической коррозии является совмещение на поверхности корродирующего металла реакций ионизации и разряда его ионов с какой-либо другой электродной реакцией, протекающей преимущественно в катодном направлении.
В водных средах, не содержащих иных окислителей, кроме ионов водорода и растворенного кислорода, это условие выполняется в том случае, если равновесный потенциал металла отрицательнее равновесного потенциала водородного или кислородного электродов в растворе данного состава. Добавление к раствору других окислителей с более положительным равновесным потенциалом увеличивает число металлов, способных корродировать. Так, серебро, стойкое в водных растворах не восстанавливающихся кислот, корродирует при добавлении окислителя с потенциалом более положительным, чем равновесный потенциал серебряного электрода.
4 Основы кинетической теории коррозии и ее приложение к коррозии идеально чистых металлов
Протекание процесса растворения металла указывает на то, что в данных условиях скорость ионизации больше скорости разряда его ионов:
![]()
В отсутствии внешнего тока и при условии сохранения неизменной величины потенциала такое соотношение скоростей возможно лишь в том случае, если скорость разряда водородных ионов на ту же величину больше скорости обратного процесса, то есть:
