Теоретические основы электрохимической коррозии
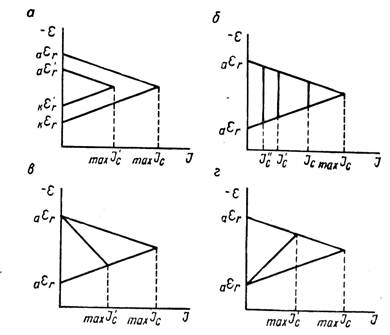
Рисунок 3 - Коррозионные диаграммы влияния различных факторов на скорость коррозии
В теории локальных элементов первоначально предполагалось, что катодный и анодный процессы должны быть обязательно пространственно разделены, и каждый из них может протекать лишь на вполне определенном участке поверхности корродирующего металла. На этом основании считалось, что идеально чистые металлы с совершенно однородной поверхностью не должны подвергаться коррозии. Такое заключение ошибочно и с термодинамической, и с кинетической точек зрения. Чтобы обеспечить протекание коррозии, необходима разница между обратимым потенциалом металла и потенциалами анодной и катодной реакций, возможных в данных условиях, а не пространственное разделение катодных и анодных участков. Анодные и катодные реакции в зависимости от степени однородности границы раздела металл - среда могут протекать на одной и той же поверхности или на ее различных участках. Совмещение катодных и анодных реакций типично для коррозии чистых металлов и амальгам; их более или менее полное пространственное разделение - для коррозии технических металлов. Меньшая стойкость технических металлов по сравнению с чистыми, а также изменение характера коррозионных разрушений во многом связаны с деятельностью гальванических микроэлементов основной металл - включение.
Коррозионные диаграммы, построенные на основе представлений теории локальных элементов, удобны для качественного рассмотрения процесса коррозии и для оценки возможного влияния на него различных факторов. В то же время их использование при количественных расчетах скорости коррозии связано со значительными трудностями. Скорость коррозии определяется изменением веса образца за единицу времени, отнесенного к единице его поверхности, или (в электрических единицах) плотностью тока i. Коррозионные же диаграммы, приведенные на рисунке 2 и 3, построены в координатах потенциал - сила тока (не включают в себя величины плотности тока, непосредственно характеризующей скорость коррозии).
Для ее расчетов нужны поэтому дополнительные данные. Задачу определения скорости коррозии можно проще решить на основе кинетической теории коррозии. В этом случае катодную и анодную поляризационные кривые снимают непосредственно на образце, коррозию которого изучают. Общую скорость коррозии выражают силой тока, отнесенной к единице всей поверхности металла, без разделения ее на катодные и анодные участки. При стационарном потенциале скорость коррозии, выражаемая силой тока анодного растворения металла, отнесенная ко всей его поверхности (включая и катодные зоны) должна быть равна скорости катодного процесса, например скорости выделения водорода. Последняя в случае снятия катодной поляризационной кривой будет равна силе тока, деленной на всю поверхность образца, включая анодные участки. Таким образом, при стационарном потенциале плотности тока для анодного и катодного процессов при указанном способе снятия поляризационных кривых должны быть одинаковыми. При этом предполагают, что омическими потерями можно пренебречь и, следовательно, рассматривать поверхность корродирующего металла как эквипотенциальную. Характер совмещенных поляризационных кривых, получаемых по этому методу, который показан на рисунке 4 (сплошные линии).
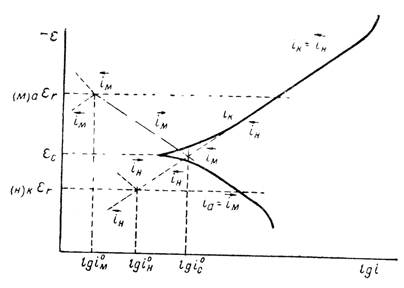
Рисунок 4 - Поляризационная диаграмма коррозионного процесса, протекающего с водородной деполяризацией
Точка пересечения анодной и катодной поляризационных кривых дает на оси абсцисс скорость коррозии, а на оси ординат - величину стационарного потенциала. Так как вблизи стационарного потенциала поляризационные данные перестают укладываться в полулогарифмическую зависимость, то скорость коррозии находят обычно по точке пересечения экстраполированных прямолинейных участков поляризационных кривых (пунктирные линии на рисунке 4). Сопоставление величин скорости коррозии, рассчитанных на основании поляризационных измерений, с полученными непосредственно из убыли веса (или по объему выделившегося водорода в кислых средах) для свинца, никеля и железа показало, что оба ряда данных совпадают друг с другом в пределах ошибок опыта. Это позволило широко использовать метод поляризационных измерений при количественном изучении коррозионных процессов.
Стационарный коррозионный потенциал εс лежит обычно между обратимыми потенциалами анодного и катодного процессов, обусловливающих появление коррозии. Он всегда положительнее равновесного потенциала анодной реакции и отрицательнее равновесного потенциала катодной реакции. Поэтому при стационарном потенциале скорость ионизации ![]() металла больше скорости разряда металлических ионов
металла больше скорости разряда металлических ионов ![]() , а скорость разряда иона водорода
, а скорость разряда иона водорода ![]() больше скорости ионизации его молекул
больше скорости ионизации его молекул ![]() . Такое соотношение скоростей сохраняется до тех пор, пока не будут достигнуты соответствующие равновесные потенциалы. В этом случае частные токи для каждого из двух процессов сделаются равными соответствующим токам обмена i0М и i0H. Продолжение катодной и анодной поляризационных кривых от стационарного потенциала до обратимых потенциалов электродных реакций показано на рисунке 4 штрихпунктирными прямыми. Скорость коррозии является функцией тока обмена катодной и анодной реакций. С увеличением тока обмена (при тех же равновесных потенциалах) скорость коррозии растет. Скорость коррозии должна меняться параллельно с изменением коэффициента переноса α. Таким образом, коррозионная диаграмма позволяет связать скорость коррозии с основными кинетическими параметрами лежащих в ее основе электродных реакций. Эту связь можно выразить и аналитически. При стационарном потенциале скорость коррозии должна быть равна скорости растворения металла и в то же время скорости катодной реакции; в рассматриваемом случае - скорости катодного выделения водорода. На этом основании можно написать следующее уравнение 10:
. Такое соотношение скоростей сохраняется до тех пор, пока не будут достигнуты соответствующие равновесные потенциалы. В этом случае частные токи для каждого из двух процессов сделаются равными соответствующим токам обмена i0М и i0H. Продолжение катодной и анодной поляризационных кривых от стационарного потенциала до обратимых потенциалов электродных реакций показано на рисунке 4 штрихпунктирными прямыми. Скорость коррозии является функцией тока обмена катодной и анодной реакций. С увеличением тока обмена (при тех же равновесных потенциалах) скорость коррозии растет. Скорость коррозии должна меняться параллельно с изменением коэффициента переноса α. Таким образом, коррозионная диаграмма позволяет связать скорость коррозии с основными кинетическими параметрами лежащих в ее основе электродных реакций. Эту связь можно выразить и аналитически. При стационарном потенциале скорость коррозии должна быть равна скорости растворения металла и в то же время скорости катодной реакции; в рассматриваемом случае - скорости катодного выделения водорода. На этом основании можно написать следующее уравнение 10:
ic = i0H℮-(kηH(1 – α)F)/RT = i0M℮(aηMα2zF)/RT , (10)
где kηH и aηM - соответственно катодная поляризация при выделении водорода и анодная поляризация при растворении металла;
(1— α) и α2 — коэффициенты переноса для реакции выделения водорода и растворения металла;
z — валентность металла.
Обозначим (1—α) через α2 и снимем индексы к и а у величины поляризации. Водородное перенапряжение в условиях коррозии равно разности между стационарным коррозионным потенциалом и обратимым потенциалом водородного электрода в данных условиях (уравнение 11):
ηH = εc - Hεr (11)
Аналогичное уравнение справедливо для анодной поляризации металла (уравнение 12).
ηМ = εc - Мεr (12)
Подставив в уравнение 10 вместо ηH и ηМ их значение из уравнения 11 и 12, решим полученное уравнение относительно стационарного потенциала коррозии (уравнение 13).
