Теплоемкость органических веществ и ее прогнозирование методом Бенсона и при повышенном давлении
Теплоемкость есть свойство вещества, характеризующее отношение количества тепла, сообщенного этому веществу, к вызванному им изменению температуры. Согласно более строгому определению, теплоемкость - термодинамическая величина, определяемая выражением
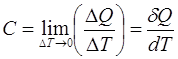 , (3.1)
, (3.1)
где ![]() - количество теплоты, сообщенное системе и вызвавшее изменение ее температуры на
- количество теплоты, сообщенное системе и вызвавшее изменение ее температуры на ![]() .
.
Знание теплоемкости необходимо для выполнения самых разнообразных расчетов, например, при расчете тепловых балансов, при проектировании всевозможной теплообменной аппаратуры и реакторов, при расчете химического равновесия и пр. Знание температурной зависимости теплоемкости необходимо при определении энтропии вещества, изучение теплоемкости вещества несет важную информацию о строении его молекул и пр.
При практических расчетах используются следующие понятия:
· средняя теплоемкость - это отношение конечных разностей ![]() ;
;
· истинная теплоемкость - это отношение бесконечно малых величин ![]() ;
;
· теплоемкость при постоянном объеме - соответствует процессу подвода тепла при постоянном объеме, когда не совершается работа расширения и количество тепла соответствует изменению внутренней энергии
![]() ; (3.2)
; (3.2)
· теплоемкость при постоянном давлении
![]() (3.3)
(3.3)
соответствует процессу подвода тепла при постоянном давлении, когда повышение температуры приводит к изменению объема и, таким образом, одновременно совершается некоторая работа расширения ![]() . Поскольку при изобарическом нагревании часть тепла помимо увеличения внутренней энергии идет на работу расширения, то
. Поскольку при изобарическом нагревании часть тепла помимо увеличения внутренней энергии идет на работу расширения, то ![]() .
.
Для идеального газа
![]() , (3.4)
, (3.4)
где R – газовая постоянная.
На величину теплоемкости влияет природа вещества. Так, газы со сходным строением молекул имеют близкие значения теплоемкостей. С усложнением строения молекул теплоемкость, как правило, возрастает. Повышение температуры также обычно приводит к росту теплоемкости. Температурную зависимость теплоемкости нельзя получить на основе законов термодинамики, ее определяют опытным путем. Зависимость теплоемкости от температуры имеет достаточно сложный вид, для описания ее в относительно узком интервале температур в большинстве случаев используют степенные уравнения вида
![]() (3.5)
(3.5)
или
![]() . (3.6)
. (3.6)
Значения коэффициентов этих уравнений для многих веществ можно найти в [6].
Влияние температуры на теплоемкость жидкости меньше, чем на теплоемкость газов. Теплоемкость твердых тел при низких температурах резко уменьшается и стремится к нулю при приближении температуры к абсолютному нулю.
Теплоемкость многоатомных газов, находящихся под небольшими давлениями, практически зависит только от температуры (у одноатомных, идеальных газов она постоянна). Теплоемкость реальных газов меняется и с температурой, и с давлением, причем с повышением температуры эффект воздействия давления уменьшается. Влияние давления велико вблизи кривой насыщения, в сверхкритической и особенно в критической области, так как в критической точке значение Cv проходит через максимум, а Cp стремится к бесконечности. Влиянием давления на теплоемкость твердых тел можно пренебречь. Теплоемкость жидкостей с давлением меняется незначительно; только вблизи кривой насыщения и более всего в критической области влияние давления становится существенным.
Экспериментальное определение теплоемкости обычно проводят при постоянном давлении, и потому в справочной литературе чаще приводятся значения Cр. В практике химических расчетов также чаще используются теплоемкости при постоянном давлении, поэтому в “Пособии” нами рассмотрены методы их прогнозирования. Ниже приведены методы прогнозирования теплоемкости при постоянном давлении, равном стандартному (1 физическая атмосфера) - ![]() .
.
При оценочных расчетах можно считать, что для большинства жидкостей их удельная теплоемкость лежит в пределах от 1,7 Дж/(г×К) до 2,5 Дж/(г×К). Исключение составляют H2O и NH3, для которых удельная теплоемкость равна примерно 4 Дж/(г×К), а также многие галогенпроизводные органических соединений, для которых удельная теплоемкость составляет 0,6–1,5 Дж/(г×К). Теплоемкость насыщенного пара при сравнительно небольших давлениях можно принять равной 2/3 от теплоемкости жидкости. Теплоемкость веществ, находящихся в твердом состоянии (при температурах не очень низких), можно считать примерно в 2 раза большей теплоемкости того же вещества в газообразном состоянии.
3.1. Расчет теплоемкости органических веществ
методом Бенсона [5-7, 17-18]
В табл. 1.2 приведены значения групповых вкладов для расчета теплоемкостей веществ, находящихся в состоянии идеального газа, при температурах, кратных 100 К. Расчет ![]() при указанных температурах выполняется аналогично прогнозированию энтальпии образования и энтропии соединений путем суммирования парциальных вкладов схемы Бенсона и введением соответствующих поправок. В отличие от энтропии при расчете теплоемкости веществ используются только те поправки, которые приведены в табл. 1.2. При расчете теплоемкости следует иметь в виду, что таблица Бенсона составлена таким образом, что для каждого из парциальных вкладов в соседних столбцах корректной является линейная интерполяция. Последний прием используется при вычислении теплоемкостей веществ, находящихся при температурах, которые не кратны 100 К.
при указанных температурах выполняется аналогично прогнозированию энтальпии образования и энтропии соединений путем суммирования парциальных вкладов схемы Бенсона и введением соответствующих поправок. В отличие от энтропии при расчете теплоемкости веществ используются только те поправки, которые приведены в табл. 1.2. При расчете теплоемкости следует иметь в виду, что таблица Бенсона составлена таким образом, что для каждого из парциальных вкладов в соседних столбцах корректной является линейная интерполяция. Последний прием используется при вычислении теплоемкостей веществ, находящихся при температурах, которые не кратны 100 К.
Расчет теплоемкости методом Бенсона иллюстрируется примером 3.1.
Пример 3.1
Методом Бенсона рассчитать теплоемкость изобутилбензола в идеально-газовом состоянии (![]() ) при 300, 400, 500, 600, 800 и 1000 К. Представить графически и аналитически температурную зависимость
) при 300, 400, 500, 600, 800 и 1000 К. Представить графически и аналитически температурную зависимость ![]() .
.
Рассчитать теплоемкость ![]() изобутилбензола при 325,0, 487,5 и 780,0 К, используя возможности метода Бенсона и результаты аппроксимации
изобутилбензола при 325,0, 487,5 и 780,0 К, используя возможности метода Бенсона и результаты аппроксимации ![]() от температуры. Сопоставить полученные результаты.
от температуры. Сопоставить полученные результаты.
Решение
1. Рассчитываются теплоемкости при заданных температурах. Результаты расчета для 300, 400, 500, 600 и 800 К приведены в табл. 3.1.
