Физико-химические основы коагулирования примесей воды
При добавлении электролита к коагулируемому коллоиду можно заметить, что коагуляция начинается не в изоэлектрической точке, а при значении потенциала 0,03 В (значение потенциала для большинства коллоидов обычно составляет 0,07 В). Это значение потенциала является мерой устойчивости коллоидных систем и называется критическим; с его уменьшением устойчивость коллоидной системы снижается.
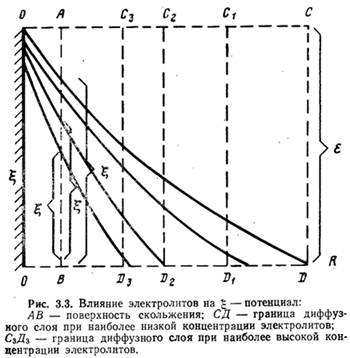
Изменение значения g-потенциала при сжатии диффузного слоя показано на рис. 3.3 (по оси абсцисс отложены расстояния от поверхности частички, по оси ординат — значения потенциалов). Степень влияния ионов зависит от их концентрации, валентности и размеров: чем выше концентрация ионов и их валентность, тем больше сжатие диффузного слоя, а следовательно, тем сильнее эти ионы снижают устойчивость коллоидных частичек.
Так происходит коагуляция гидрофобных золей, обусловленная адсорбцией ионов и созданием двойного электрического слоя на поверхности коллоидных частичек. Их устойчивость в растворе определяется гидратацией ионов и влиянием зарядов поверхности на ориентированную адсорбцию дипольных молекул воды. Эти гидратные слои полностью зависят от ионных взаимодействий и при электролиткой коагуляции не препятствуют слипанию частичек.
Совершенно иной характер устойчивости имеют гидрофильные золи, природа поверхности частичек которых обусловливает образование молекулярных сольватных слоев при участии вандерваальсовских, водородных и комплексных связей, вне зависимости от действия растворов электролитов небольших концентраций. Высокоочищенные золи H2SiO3 и А1(ОН)3 могут сохраняться в растворе даже при снижении g-потенциала почти до нуля.
Значение гидратных слоев объяснено тем, что для сближения коллоидных частичек необходимо затратить работу на преодоление сопротивления так называемого «расклинивающего давления», обусловленного силами молекулярного сцепления воды с поверхностью частичек. На расстоянии 1 нм и меньше силы взаимного притяжения частичек преобладают над силами сцепления в гидратном слое. При больших расстояниях гидратные слои являются термодинамически устойчивым стабилизирующим фактором.
Аналогично влияют поверхностно-активные вещества. Изменение гидрофильности поверхности частичек в данном случае зависит от ориентации молекул поверхностно-активных веществ в адсорбционном слое. Увеличение гидрофильности и возрастание устойчивости коллоидных частичек в водных системах наблюдается, если полярные группы адсорбированных соединений обращены в сторону дисперсионной среды. Ориентация приобретает особое значение при образовании молекулами поверхностно-активных веществ в адсорбционных слоях двухмерных гелеобразных структур, обладающих повышенными структурно-механическими свойствами. Это явление называется коллоидной защитной, которая заключается в том, что при добавлении гидрофильных веществ к гидрофобным коллоидам они образуют структурно-прочные адсорбционные слои на поверхности частичек и повышают устойчивость последних по отношению к электролитам-коагулянтам.
Добавление к золю небольших количеств высокомолекулярных соединений (ВМС), которые не обеспечивают полного покрытия поверхности частичек золя, вызывает явление, противоположное коллоидной защите, — сенсибилизацию, т. е. повышение чувствительности золя к действию электролитов. Сенсибилизирующее действие ВМС проявляется независимо от знака заряда поверхности частичек золей. Термодинамическая устойчивость таких растворов определяется тем, что связь молекул полимерного соединения с водой сильнее их взаимной связи в твердой фазе и тем, что они равномерно распределены во всем объеме растворителя.
При очистке воды коагуляция коллоидов протекает под влиянием сложной смеси электролитов, находящихся в воде, и под влиянием ионов, вносимых в воду вместе с коагулянтом. Так, в случае применения Ai2(S04)3, в воду вносят значительные количества ионов S042-.
Если в качестве коагулянта используется FeCl3, в очищаемой воде повышается содержание ионов С1-. Наличие смеси электролитов усложняет коагуляцию, поскольку при этом эффекты влияния отдельных коагулирующих ионов усиливаются или ослабляются.
Коагуляция коллоидов вызывается не только электролитами, но и взаимодействием противоположно заряженных коллоидов, наступающим при адсорбции одного коллоида поверхностью другого. Этот процесс играет некоторую роль при осветлении воды коагулированием. Необходимым условием взаимной коагуляции является равенство противоположных зарядов частичек золей. При несоблюдении этого условия коагуляция протекает либо неполно, либо вовсе не наступает, независимо от количества прибавленного коагулирующего коллоида. Отсюда следует, что взаимная коагуляция коллоидов может протекать лишь в узкой зоне соотношения их концентраций.
Большинство коллоидов природных вод в отличие от золей коагулянтов заряжено отрицательно. К таким коллоидам относятся распространенные в природных водах кремниевая кислота, мельчайшие глинистые и почвенные частички, а также гумусовые вещества. Глинистые и почвенные взвеси состоят в основном из гидроалюмосиликатов.
Вода, входящая в состав глины, по современным представлениям не является кристаллогидратной. Молекула глины представляет собой молекулу алюмосиликатной кислоты, в которой кислород воды входит в состав аниона, а водород является катионом; простейшая формула гидроалюмосиликата в этом случае выглядит так.
Анионы алюмосиликата образуют основу отрицательно заряженной глинистой частички, окруженной сферой положительных компенсирующих ионов водорода. Величина заряда глинистой частички и его знак зависят от рН воды, в которой суспензирована глина, поскольку при повышении концентрации, ионов водорода уменьшается диссоциация алюмосиликатной кислоты, а благодаря этому и количество свободных ионов, обусловливающих устойчивость коллоидных частичек. Опыт подтверждает, что глинистые взвеси значительно скорее отстаиваются и коагулируют при подкислении воды.
Гумусовые вещества, также имеющие кислотный характера в природных водах встречаются в виде стойких высокодисперсных отрицательно заряженных золей. Основу частичек составляют анионы, гуминовых кислот; ионы водорода или металлов, составляют внешнюю оболочку двойного электрического слоя.
Большинство веществ, обусловливающих мутность и цветность природных вод, являются гидрофобными, или слабогидрофильными коллоидами. Гидрофобны или слабогидрофильны и коллоиды, образующиеся при очистке воды в результате гидролиза вводимых в воду коагулянтов. Поэтому полное представление о поведении коллоидов в процессе очистки природных вод можно получить лишь при учете факторов устойчивости гидрофобных и гидрофильных коллоидов.
На наличие гидрофильных свойств у коллоидов природных вод указывают три фактора: малая чувствительность к содержанию электролитов; способность удерживать значительное количество воды их скоагулированными осадками; для некоторых из них, в особенности для продуктов разложения белковых веществ и гуминов, характерно проявление защитного действия по отношению к глинистым и почвенным суспензиям, коллоидной кремниевой кислоте, а также к золям гидроксидов алюминия и железа (III), образующихся при внесении в воду коагулянтов.
