Физико-химические основы коагулирования примесей воды
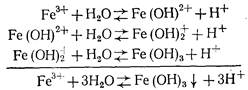
Гидролиз железного купороса в воде выражается уравнением
![]()
Поскольку растворимость Fe(OH)2 велика и он значительно диссоциирован, равновесие гидролиза сильно смещено влево. Образующийся Fe(OH)2 под действием кислорода, растворенного в воде, окисляется в Fe(OH)3:
![]()
Хлопья FeCb наиболее интенсивно образуются при рН=5 . . 7, причем оптимум находится между значениями рН 6,1 и 6,5. Изоэлектрическая точка Fe(OH)3 соответствует значению рН несколько большему, чем 6,5. Хлопьеобразование Fe(OH)3, в отличие от Аl(ОН)3, протекает в значительно более широком диапазоне значений рН. Рентгенографически установлено, что при гидролизе солей железа (III) в гидрокарбонатно-хлоридных и гидрокарбонатно-сульфатных средах образуется одна и та же модификация гидроксида железа(III) — гетитa-FeO(OH). Характерно, что a-гидроксид железа(III) образуется и в случае гидролиза солей железа(II), например, железного купороса, окисляемого хлором или растворенным в воде кислородом при подщелачивании известью.
Для нормальной коагуляции большую роль играют размеры и структура частичек гидроксидов, причем размеры частичек, выделяющихся при гидролизе коагулянтов, зависят главным образом от степени пересыщения раствора. В процессе водоочистки гидролиз солей-коагулянтов протекает в разбавленных растворах, что создает условия слабого пресыщения и благоприятствует образованию крупных частичек при обеспечении необходимого периода времени на их формирование. Структура выделяющихся из раствора частичек зависит от скорости двух протекающих одновременно процессов: беспорядочного слипания частичек при столкновениях (агрегации) и роста кристаллов (ориентации). При незначительном пересыщении главную роль играет скорость ориентации, которая у гидроксидов понижается с увеличением числа гидроксильных ионов, связанных с атомом металла. Поэтому частички гидроксидов двухвалентных металлов имеют кристаллическую форму, а гидроксиды трехвалентных металлов (алюминия и железа) выделяются главным образом в аморфном состоянии.
Процесс искусственного обесцвечивания воды согласно современным представлениям протекает следующим образом. При добавлении к очищаемой воде раствора коагулянтов в течение первых 30—180 с происходит гидролиз добавленных солей и образуются коллоидные гидроксиды алюминия и железа, имеющие огромные активные поверхности. Коллоидные примеси, содержащиеся в воде, адсорбируются на поверхности частичек Гидроксидов. При адсорбции следует различать два процесса: собственно адсорбцию и фиксацию (закрепление) адсорбированных коллоидов на поверхности. В первом процессе главную роль играют силы межмолекулярного взаимодействия. Адсорбция коллоидных частичек зависит от их дисперсности: она тем больше, чем выше дисперсность и чем меньше устойчивость частичек.
Причины фиксации могут быть различными. Чаще всего необходимость процесса адсорбции гуминов и других коллоидных загрязнений воды на поверхности гидроксидов вызывается образованием особого рода поверхностных соединений — лаков. Большое значение в процессе фиксации адсорбированных коллоидов имеет их коагуляция вследствие разноименности зарядов адсорбированных частичек и поверхности адсорбента. Наличие заряда у адсорбирующихся коллоидных частичек влияет на их адсорбируемость.
Коагуляция частичек Fe(OH)3 и А1(ОН)3, а также связанное с этим выделение их из воды совместно с адсорбированными на их поверхности коллоидными примесями происходит под действием растворенных в воде электролитов. В связи с этим очистка цветных вод с повышенной степенью минерализации протекает обычно лучше, чем мягких, бедных солями вод. Из описанного процесса обесцвечивания следует, что коагуляции подвергаются не коллоидные примеси воды, а образующиеся при гидролизе коагулянтов гидроксиды. Вода очищается не в результате коагуляции, а вследствие адсорбции различных коллоидных и высокомолекулярных примесей на поверхности гидроксидов. Процесс коагуляции гидроксидов фактически приводит к удалению отработанного сорбента из очищенной воды.
Характер осветления природных вод определяется свойствами взвеси: при наличии крупных частичек вода осветляется благодаря их декантации под влиянием силы гравитации, а при наличии высокодисперсных частичек осветление воды определяется их обменной катионной емкостью. Если эта емкость превышает 250 мг-экв/л, вода осветляется без добавления коагулянта в результате сжатия двойного электрического слоя за счет обмена одновалентных ионов на двух- и трехвалентные. Природные воды обычно содержат взвесь со значительно меньшей обменной емкостью. В этом случае эффективное хлопьеобразование наступает лишь при добавлении коагулянта, образующего гидроксид, к хлопьям которого прилипают частички взвеси, или он сам обволакивает взвешенные вещества. Большое значение имеет также ортокинетическая коагуляция вследствие захватывания взвеси сеткой оседающих хлопьев гидроксида. Из сказанного следует, что процесс коагулирования зависит прежде всего от солевого состава воды, главным образом от ее анионного состава, поскольку Fe(OH)3 и А1(ОН)3 заряжены положительно и коагулирующими ионами для них являются анионы. Самыми распространенными анионами большинства природных вод являются НСОз~, С1~ и S042-. Концентрация этих анионов, обеспечивающая максимальную скорость коагуляции Fe(OH)3 и А1(ОН)3, составляет: для SO*2- — 0,001—0,002 н„ для С1- — 0,07 н. и для НС03- — 0,005 н. В природных водах концентрации указанных анионов обычно ниже, следовательно, коагуляция гидроксидов протекает медленнее.
ЛИТЕРАТУРА
1. Алексеев Л.С., Гладков В.А. Улучшение качества мягких вод. М., Стройиздат, 1994 г.
2. Алферова Л.А., Нечаев А.П. Замкнутые системы водного хозяйства промышленных предприятий, комплексов и районов. М., 1984.
3. Аюкаев Р.И., Мельцер В.3. Производство и применение фильтрующих
4. материалов для очистки воды. Л., 1985.
5. Вейцер Ю.М., Мииц Д.М. Высокомолекулярные флокулянты в процессах очистки воды. М., 1984.
6. Егоров А.И. Гидравлика напорных трубчатых систем в водопроводных очистных сооружениях. М., 1984.
7. Журба М.Г. Очистки воды на зернистых фильтрах. Львов, 1980.
