Физико-химические основы коагулирования примесей воды
Защита гидрофобных коллоидов, с точки зрения технологии очистки воды, явление нежелательное, поскольку она вызывает образование стойких связей и замедляет осаждение коагулянта.
Коллоидные частички гидрофильных органических коллоидов представляют собой агрегаты молекул, свернутых в рыхлый клубок, промежутки в котором заполнены водой. Полярными группами в них (например, в гуминовых веществах) являются фенольные и карбоксильные. Устойчивость гидрофильных коллоидов объясняется развитой гидратной оболочкой. Например, у полярных групп ОН-, С032_, НС03-, образующих коллоидные гидрофильные частички, молекулы воды, представляющие собой диполи, ориентируются и притягиваются в результате электростатического взаимодействия. По мере удаления от поверхности полярных молекул ориентация молекул воды ослабевает. Устойчивость гидрофильных систем снижается при химической обработке, в результате которой полярные группы НСО3- окисляются до карбонильных — гидрофобных (количество полярных групп в молекуле уменьшается). Для этой цели применяют предварительное хлорирование воды перед введением коагулянта.
Используемые в технологии очистки воды коагулянты чаще всего являются солями слабых оснований а сильных кислот (A12(S04)3, FeS04, FeCl3 и др.). При растворении они гидролизуют. Взаимодействуя с гидроксильными ионами, содержащимися в воде, в результате электролитической диссоциации последней эти соли образуют малорастворимые основания. В воде накапливаются ионы водорода, и раствор приобретает кислую реакцию.
Полнота гидролиза имеет большое значение как для самой коагуляции, так и для качества очищаемой воды, поскольку наличие ионов алюминия в очищенной питьевой воде недопустимо.
Скорость гидролиза можно описать уравнением:
![]()
где v — скорость гидролиза; Кг — константа гидролиза; [Мел+] — концентрация катионов в растворе коагулянта; [Н20] — концентрация воды в растворе.
Из уравнения следует, что скорость гидролиза пропорциональна концентрации катионов коагулянта. Поскольку применяющиеся концентрации растворов коагулянта незначительны, можно считать, что скорость гидролиза коагулянта прямо пропорциональна его концентрации (или его дозе), введенной в воду. Согласно правилу Вант—Гоффа с повышением температуры на каждые 10 градусов скорость гидролиза, как и большинства химических реакций, возрастает примерно в 2—4 раза.
Необходимым условием для более полного протекания гидролиза является удаление из сферы реакции образующихся Fe(OH)3 или А1(ОН)3, а также связывание ионов Н+ в малодиссоциированные молекулы. Гидролиз усиливается с разбавлением коагулянта.
Более полному гидролизу подвержены коагулянты, образующие гидроксиды с меньшей константой диссоциации (величиной, характеризующей способность электролитов диссоциировать на ионы) или меньшим произведением растворимости.
Гидролиз солей железа (III) протекает полнее, чем солей алюминия, и значительно полнее, чем солей железа (II).
Как следует из уравнения, с увеличением степени гидролиза рН раствора должно уменьшаться. Любое повышение рН раствора обеспечивает полный гидролиз введенного в воду коагулянта. Для быстрого и полного гидролиза коагулянтов необходим некоторый щелочной резерв воды, т. е. наличие в ней определенного количества ионов НС03-, ОН-, которые связывают ионы водорода, выделяющиеся при гидролизе:
![]()
Благодаря наличию в воде буферной системы НС03-—Н2СО3 с рН, близким к 7, рН воды при гидролизе коагулянтов в большинстве случаев изменяется незначительно (уменьшается).
По уравнению гидролиза коагулянтов можно вычислить концентрацию ионов НС03-, необходимую для нейтрализации кислоты, образующейся при гидролизе определенной дозы коагулянта. Из суммарной реакции гидролиза Al2(S04)3 в присутствии ионов НС03-
Al2 (S04)3 + ЗСа (НС03)2 + 6Н20 = 2А1 (0Н)3 + 3CaS04 + 6Н2СО
следует, что на каждые 342 м г A12(S04)3 расходуется 6 мг-экв НСОз-.
В тех случаях, когда концентрация ионов ОН-, НС03~, содержащихся в воде, недостаточна для полного гидролиза коагулянта, щелочность воды повышают введением известкового молока или раствора соды. В первом случае эффект подщелачивания объясняется связыванием ионов Н+ ионами ОН- извести, во втором — связыванием ионов Н+ в ионы НС03-.
Зная щелочность обрабатываемой воды и дозу введенного коагулянта, можно вычислить дозу извести или соды, необходимой для гидролиза и обеспечения резервной остаточной щелочности, равной 1 мг-экв/л.
Гидролиз солей алюминия, используемых в качестве коагулянтов, протекает в несколько стадий:
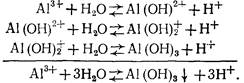
Степень гидролиза повышается с разбавлением раствора, повышением его температуры и рН.
Гидроксид алюминия является типичным амфотерным соединением, т. е. обладает как кислотными, так и основными свойствами:
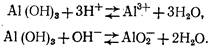
Константа равновесия для первого уравнения
![]()
(А1(ОН)3 содержится в твердой фазе и концентрация его в растворе постоянна), откуда [Al3+]=k'[H+]3.
Для второго уравнения константа равновесия:
![]()
Или
![]()
откуда
![]()
седиментация примесь коагуляция гидролиз
где к® — ионное произведение воды (величина постоянная, зависящая только от температуры).
Таким образом, растворимость А1(ОН)3 в кислой среде, прямо пропорциональна концентрации водородных ионов в третьей степени [Н+]3, а в щелочной — обратно пропорциональна [Н+].
Осаждение А1(ОН)3 начинается при рН=3 и становится полным при рН=7. Дальнейшее повышение рН ведет к растворению осадка (пептизации), заметному при рН=9. Рентгенографически установлено, что в гидрокарбонатно-хлоридных и гидрокарбонатно-сульфатных средах частички формируются с образованием гидроаргиллита —А1(ОН)3, способного существовать в этих условиях длительное время.
При коагулировании в кислых и нейтральных средах, содержащих небольшое количество гидрокарбонатов, для нейтрализации ионов Н+, накапливающихся в воде при гидролизе A12(S04)3, можно применять смесь A12(S04)3 и NaA102. В этом случае накапливающиеся ионы Н+ будут нейтрализоваться ионами ОН-, образующимися при гидролизе NaAl02:
![]()
Если в смеси выдержано необходимое соотношение между A12(S04)3 и NaA102, то при гидролизе значение воды практически не изменяется и гидролиз обоих реагентов протекает достаточно полно.
Гидролиз FeCI3 протекает в три стадии:
