Характеристика белков
Расстояние между атомами С и N (в -СО-NH-связи) равно 0,1325 нм, то есть меньше нормального расстояния между a-углеродным атомом и атомом N той же цепи, выражаемого величиной 0,146 нм. Вместе с тем оно превышает расстояние между атомами С и N, соединенными двойной связью (0,127 нм). Таким образом, связь С и N в -СО-NH -группировке может рассматриваться как промежуточная между простой и двойной вследствие сопряжения π-электронов карбонильной группы со свободными электронами атома азота. Это определенным образом сказывается на свойствах полипептидов и белков: по месту пептидных связей легко осуществляется таутомерная перегруппировка, приводящая к образованию енольной формы пептидной связи, отличающейся повышенной реакционной способностью.
Элементный состав белков
Белки содержат в среднем около 1 6% азота, 50-55% углерода , 21-23% кислорода , 15-17% азота , 6-7% водорода , 0,3-2,5% серы .В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
Содержание основных химических элементов в белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством.
Для изучения аминокислотного состава белков используется главным образом метод гидролиза, то есть нагревание белка с 6-10 моль/ литр соляной кислотой при температуре 100-110 0С. получают смесь a-аминокислот, из которых можно выделить индивидуальные аминокислоты. Для количественного анализа этой смеси в настоящее время применяют ионообменную и бумажную хроматографию. Сконструированы специальные автоматические анализаторы аминокислот.
Разработаны также ферментативные методы ступенчатого расщепления белка. Некоторые ферменты расщепляют макромолекулу белка специфически – только в местах нахождения определенной аминокислоты. Так получают продукты ступенчатого расщепления - пептоны и пептиды, последующим анализом которых устанавливают их аминокислотный остаток.
В результате гидролиза различных белков выделено не более 30 a-аминокислот. Двадцать из них встречаются чаще других.
При образовании молекулы белка или полипептида a-аминокислоты могут соединяться в различной последовательности . Возможно огромное число различных комбинаций, например из 20 a-аминокислот можно образовать больше 1018 комбинаций. Существование различного типа полипептидов практически неограничено.
Последовательность соединения аминокислот в том или ином белке устанавливают путем ступенчатого расщепления или рентгеноструктурным анализом.
Для идентификации белков и полипептидов используют специфические реакции на белки. Например :
а) ксантопротеиновая реакция ( появление желтого окрашивания при взаимодействии с концентрированной азотной кислотой, которое в присутствии аммиака становиться оранжевым ; реакция связана с нитрованием остатков фенилаланина и тирозина);
б) биуретовая реакция на пептидные связи – действие разбавленного сульфата меди (II) на слабощелочной раствор белка сопровождающийся появлением фиолетово-синей окраски раствора ,что обусловлено комплексообразованием между медью и полипептидами.
в) реакция Миллона (образование желто-коричневого окрашивания при взаимодействии с Hg(NO3)2 + HNO3 + HNO2;
Молекулярная масса
Белки являются высокомолекулярными соединениями. Это полимеры, состоящие из сотен и тысяч аминокислотных остатков — мономеров. Соответственно и молекулярная массабелков находится в пределах 10000-1000000. Так, в составе рибонуклеазы (фермента, расщепляющего РНК) содержится 124 аминокислотных остатка и ее молекулярная масса составляет примерно 14000. Миоглобин (белок мышц), состоящий из 153 аминокислотных остатков, имеет молекулярную массу 17000, а гемоглобин – 64500 (574 аминокислотных остатка). Молекулярные массы других белков более высокие: g-глобулин (образует антитела) состоит из 1250 аминокислот и имеет молекулярную массу около 150000, а молекулярная масса белка вируса гриппа – 320 000 000.
Аминокислоты
В настоящее время в различных объектах живой природы обнаружено до 200 различных аминокислот. В организме человека их, например, около 60. Однако в состав белков входят только 20 аминокислот, называемых иногда природными.
Аминокислоты — органические кислоты, у которых атом водорода a-углеродного атома замещен на аминогруппу –NH2. Следовательно, по химической природе это a-аминокислоты с общей формулой:
COOH
H–C*–NH2
R
Из формулы видно, что в состав всех аминокислот входят следующие общие группировки: –C–, –NH2, –COOH. Боковые же цепи (радикалы –R) аминокислот различаются. Природа радикалов разнообразна: от атома водорода до циклических соединений. Именно радикалы определяют структурные и функциональные особенности аминокислот.
Все аминокислоты, кроме простейшей аминоуксусной кислоты — глицина (NH3+CH2COO-) имеют хиральный атом - C*- и могут существовать в виде двух энантиомеров (оптических изомеров): L-изомер и D-изомер.
В состав всех изученных в настоящее время белков входят только аминокислоты L-ряда, у которых, если рассматривать хиральный атом со стороны атома H, группы NH3+, COO- и радикал -R расположены по часовой стрелке. Необходимость при построении биологически значимой полимерной молекулы строить ее из строго определенного энантиомера очевидна — из рацемической смеси двух энантиомеров получилась бы невообразимо сложная смесь диастереоизомеров. Вопрос, почему жизнь на Земле основана на белках, построенных именно из L-, а не D-a-аминокислот, до сих пор остается интригующей загадкой. Следует отметить, что D-аминокислоты достаточно широко распространены в живой природе и, более того, входят в состав биологически значимых олигопептидов.
Структура
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную структуры.
Первичная структура
Представляет собой линейную цепь аминокислот (полипептид), расположенных в определенной последовательности с четким генетически обусловленным порядком чередования и соединенных между собой пептидными связями.
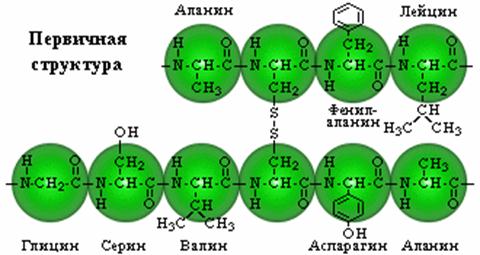

Пептидная связьобразуется за счет a-карбоксильной группы одной аминокислоты и a-аминной группы другой
К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков. Запись структуры белков в виде развернутых структурных формул громоздка и не наглядна. Поэтому используется сокращенная форма записи — трехбуквенная или однобуквенная.
