Характеристика белков
Необратимое осаждение связано с глубокими внутримолекулярными изменениями структуры белка, что приводит в потере ими нативных свойств — денатурации , которая влечет потерю растворимости, биологической активности и т.д. Необратимое осаждение можно вызвать кипячением, действием концентрированными растворами некоторых из минеральных и органических кислот, солями тяжелых металлов . Примером естественно вызванной денатурации служит расщепление белков в желудке, где имеется сильнокислая среда (рН 0,5–1,5), под действием протеолитических ферментов. Денатурация белков положена в основу лечения отравления тяжелыми металлами, когда больному вводят per os (“через рот”) молоко или сырые яйца с тем, чтобы металлы адсорбировались на поверхности денатурирующего белка и не действовали на белки слизистой оболочки желудка и кишечника, а также не всасывались в кровь.
Гидролиз белка достигается при помощи кипячения белка с сильными минеральными кислотами (кислотный гидролиз) или основаниями (щелочной гидролиз). Схема следующая:
О H О Н О О
![]()
![]() NH2 — СН—С—N—СH—С—N—СН—С— ·· + nH2O ·· + NH2—СН—С—ОН +
NH2 — СН—С—N—СH—С—N—СН—С— ·· + nH2O ·· + NH2—СН—С—ОН +
R1 R2 R3 R1
O O
+ NH2—СН—С—ОН + NH2—СН—С—ОН + ··
R2 R3
Химический синтез
Химический синтез белков имеет большое практическое и теоретическое значение. В практическом отношении важны белковые гормоны — инсулин и вазопрессин, в настоящее время получаемые синтетическим путем. Умение производить искусственным путем необходимые белки откроет огромные ресурсы для использования в медицине, технике и т.д.
Традиционные методы синтеза регулярных полимеров позволяют получить сополимеры, состоящие из двух (или более) сходных типов мономеров со статистическим распределением их по цепи, в том числе белков. В частности, возможно получение гомополимеров или статистических сополимеров, состоящих из аминокислотных остатков, связанных пептидными связями (полиаминокислот).
В качестве примера можно привести процесс получения полиаминокислот, основанный на конденсации N-карбоксиангидридов аминокислот, образуемых из соответствующих аминокислот обработкой фосгеном:
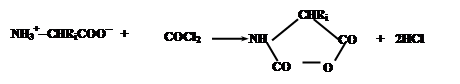 |
Эти соединения содержат электрофильную ангидридную группу, которая может атаковать алифатическую аминогруппу аминокислоты, используемой в качестве затравки, с выделением СО2 и одновременном освобождением новой аминогруппы из атакующей молекулы N-карбоксиангидрида, таким образом, открывая возможность поликонденсации:
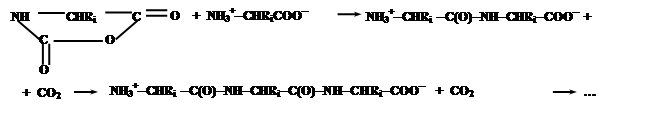
Нетрудно заметить, что каждая стадия поликонденсации (с учетом реакции образования N-карбоксиангидридов аминокислот) сопровождается превращением молекулы COCl2 в CO2 и 2HCl, что термодинамически выгодно и является источником свободной энергии для образования пептидной связи.
При синтезе нерегулярных полипептидов базируются также на активации карбоксильных групп. Большинство из них базируется на использовании N,N-дициклогексилкарбодиимида (ДЦК). Он способен в присутствии RCOO- и амина NH2R’ осуществить активацию карбоксильных групп:
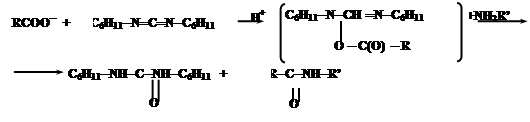
Промежуточным соединением является O-ацил-N,N’-дициклогексилмочевину (ДЦМ):
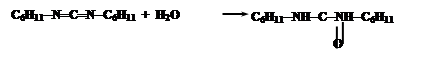
Значение белков
Функции белков чрезвычайно многообразны. Каждый данный белок как вещество с определенным химическим строением выполняет одну узкоспециализированную функцию и лишь в нескольких отдельных случаях — несколько взаимосвязанных. Например, гормон мозгового слоя надпочечников адреналин, поступая в кровь, повышает потребление кислорода и артериальное давление, содержание сахара в крови, стимулирует обмен веществ, а также является медиатором нервной системы у холоднокровных животных.

 |

![]() Белки
Белки
 | |||
 | |||
Схема практического значения белков
.
Каталитическая (ферментативная) функция
Многочисленные биохимические реакции в живых организмах протекают в мягких условиях при температурах, близких к 40°С, и значениях рН близких к нейтральным. В этих условиях скорости протекания большинства реакций ничтожно малы, поэтому для их приемлемого осуществления необходимы специальные биологические катализаторы — ферменты. Даже такая простая реакция, как дегидратация угольной кислоты:
![]()
![]() CO2 + H2O HCO3-+ H+
CO2 + H2O HCO3-+ H+
катализируется ферментом карбоангидразой. Вообще все реакции, за исключением реакции фотолиза воды 2H2O®4H+ + 4e- + O2, в живых организмах катализируются ферментами (реакции синтеза, осуществляются при помощи ферментов синтетаз, реакции гидролиза — при помощи гидролаз, окисление — при помощи оксидаз, восстановление с присоединением — при помощи гидрогеназ и т.д.). Как правило, ферменты — это либо белки, либо комплексы белков с каким-либо кофактором — ионом металла или специальной органической молекулой. Ферменты обладают высокой, иногда уникальной, избирательностью действия. Например, ферменты, катализирующие присоединение a-аминокислот к соответствующим т-РНК в процессе биосинтеза белка, катализируют присоединение только L-аминокислот и не катализируют присоединение D-аминокислот.
Транспортная функция белков
Внутрь клетки должны поступать многочисленные вещества, обеспечивающие ее строительным материалом и энергией. В то же время все биологические мембраны построены по единому принципу — двойной слой липидов, в который погружены различные белки, причем гидрофильные участки макромолекул сосредоточены на поверхности мембран, а гидрофобные “хвосты” — в толще мембраны. Данная структура непроницаема для таких важных компонентов, как сахара, аминокислоты, ионы щелочных металлов. Их проникновение внутрь клетки осуществляется с помощью специальных транспортных белков, вмонтированных в мембрану клеток. Например, у бактерий имеется специальный белок, обеспечивающий перенос через наружную мембрану молочного сахара — лактозы. Лактоза по международной номенклатуре обозначается b-галаткозид, поэтому транспортный белок называют b-галактозидпермеазой.
