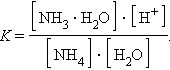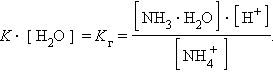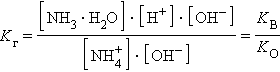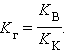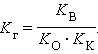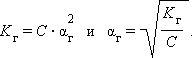Химическая термодинамика
Константа равновесия для первого случая
|
|
Так как [H2O] = const, то K∙ [H2O] = Kг – константа гидролиза. Тогда
|
|
Умножив числитель и знаменатель на [OH–], получим
|
Аналогично для гидролиза по аниону
|
|
Для гидролиза по катиону и аниону одновременно
|
|
Связь константы гидролиза со степенью гидролиза выводится подобно закону разбавления Оствальда и записывается так:
|
C – концентрация соли в моль/л.
Для малых значений αг
|
|
Для многозарядных катионов и анионов гидролиз протекает ступенчато, причем в основном по 1-й ступени.
Например, для хлорида железа (FeCl3 → Fe3+ + 3Cl–) имеем:
|
|
|
|
|
|
Распространенной ошибкой при составлении уравнений гидролиза является использование сразу более одной молекулы воды.
Сравните:
· Правильно:
|
· Неправильно:
|
|
Гидролиз хлорида железа идет преимущественно по первой ступени из-за накапливания ионов H+ и недостатка гидроксильных ионов, необходимых для протекания реакции гидролиза (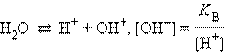 ничтожно мала).
ничтожно мала).
В результате гидролиза многозарядных катионов образуются основные соли Fe(OH)Cl2, Fe(OH)2Cl, а гидролиз многозарядных анионов приводит к образованию кислых солей (NaHCO3, NaH2PO4).
Явление гидролиза следует учитывать при приготовлении растворов. Для предотвращения гидролиза растворы солей, подвергающиеся гидролизу по катиону, необходимо подкислять.
Термохимические расчеты
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ, количество теплоты, выделяемой или поглощаемой системой при химической реакции. Тепловой эффект работы равен изменению внутренней энергии системы при постоянном объеме или изменению ее энтальпии при постоянном давлении и отсутствии работы внешних сил. В зависимости от знака теплового эффекта работы все химические реакции подразделяют на эндо- и экзотермические.
Теплота, высвобождаемая или поглощаемая конкретной химической реакцией, пропорциональна степени превращения реагентов, определяемой по количеству любого из расходуемых либо образующихся продуктов. Изменение внутренней энергии или энтальпии реагирующей системы определяют по химическому уравнению реакции. Например, сгорание смеси газообразных метана и кислорода описывается термохимическим уравнением
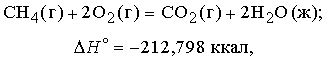
Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом DH° обозначается изменение энтальпии в химическом превращении при стандартных давлении 1 атм и температуре 298 K (25° С) (знак градуса в верхнем индексе H указывает, что данная величина относится к веществам в стандартных состояниях (при p = 1 атм и T = 298 K)).
Энтропия. Энергия Гиббса
Энергия Гиббса window.top.document.title = "4.6. Энергия Гиббса";
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным TΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
|
1 |