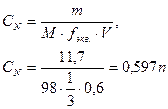Химическая термодинамика
Практическая часть
Задание № 1.
Сколько воды надо прибавить к 100 мл 48%-го раствора азотной кислоты (r=1,303 г/см3), чтобы получить раствор с массовой долей 20%?
|
Дано: ρ=1,303 г/см3 V(HNO3 )=100 мл. ω(HNO3)=48% | Решение: 1)m(HNO3) в одном литре раствора = 1303 г. В 100 мл =130,3 г В этом 48% растворе m(HNO3) = =130,3*48/100=62,544 г. m(Н2О)=130,3-62,544=67,756 г. 2) m(HNO3) в 20% растворе = 130,3*20/100 =26,06 г. m(Н2О)=130,3-26,06=104,24 г. 3) m(Н2О)=104,24-67,756=36,484 г. – необходимо добавить воды к 48% раствору. |
|
Найти: m(Н2О)-? |
Ответ: m(Н2О)=36,484 грамма.
Задание № 2.
В 600 мл раствора содержится 11,7 г ортофосфорной кислоты. Определите нормальную концентрацию раствора для полной и неполной (по I и II ступеням) нейтрализация раствора.
|
Дано: m(Н3РО4) = 11,7 г. V = 282 см3 М(Н3РО4) = 98 Fэкв. = 1/3 | Решение: Нормальная концентрация, или нормальность, показывает число моль-эквивалентов растворенного вещества, содержащихся в 1 л раствора.
|
|
Найти: СN(Н3РО4)-? |
Ответ: СN(Н3РО4)=0,597n
Задание № 3.
Сколько растворенных частиц (ионов и недиссоциированных молекул) содержит 1 л 0,0001 н. HCN, константа диссоциации которой равна 4,9-10 -10?
|
Дано: Vр-ра = 282 см3 СN(HCN)=0,0001 н Kд(HCN)=4,9*10-10 | Решение: HCN – циановодородная кислота, это слабая кислота, диссоциирует по уравнению: HCN=H++CN- Концентрация продиссоциировавших молекул, а, следовательно, и концентрация ионов H+: |
|
Найти: n(молекул)-? n(ионов)-? |
[H+]=α*С(РСТ), где α-степень диссоциации;
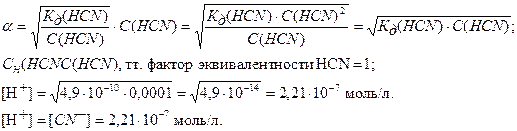
Определим млярную концентрацию непродиссоциировавших молекул HCN:
![]()
Рассчитываем число молекул и ионов:
1 моль любого вещества содержит 6,02*1023 структурных единиц (постоянная Авогадро).
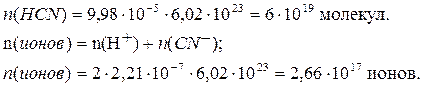
Ответ: 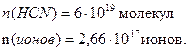
Задание № 4.
Составьте в молекулярной и молекулярно-ионной форме уравнения реакций:
а) CuCL2 + Na2C03 +H2O →… б) FеС13 + НСООК + Н2О → FeOH(HCOO)2 + . . .
Решение:
а) CuCl2-соль, образованная слабым основанием Cu(OH)2 и сильной кислотой HCl, такая соль гидролизуется по катиону:
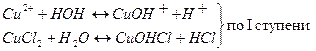
Na2CO3 – соль, образованная сильным основанием NaOH и слабой кислотой H2CO3, такая соль гидролизуется по аниону:
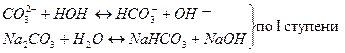
Если смешать растворы двух солей, то гидролиз усиливается за счёт образования молекулы H2O.
Уравнение совместного гидролиза:
1) молекулярное:
![]()
2) ионно-молекулярное:
![]()
б) FeCl3 – соль, образованная слабым основанием Fe(OH)3 и сильной кислотой HCl гидролизуется по катиону:
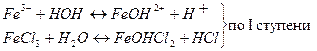
HCOOK – соль, образованная слабой кислотой HCOOH и сильным основанием KOH, гидролизуется по аниону:
![]()
Уравнение совместного гидролиза:
1) молекулярное:
![]()
2) ионно-молекулярное:
![]()
Задание № 5
Вычислите ∆Н0 реакций:
а) 2Mg + СО2 = 2 MgO + С
б) В2О3 + 3Mg = ЗМgО + 2В
в) SiO2 + 2Mg = 2MgO + Si
г) ZnO + С = СО + Zn
д) МnО2+ 2С = 2СО + Мn
e) 3Fe3O4 + 8Al = 4А12О3 + 9Fe
Решение:
![]()
![]() простых веществ равно нулю.
простых веществ равно нулю.
а) 2Mg + СО2 = 2 MgO + С
![]() 2MgO = 2*(-601,24) кДж
2MgO = 2*(-601,24) кДж
![]() CO2 = -393,51 кДж
CO2 = -393,51 кДж
![]() = -808,97 кДж
= -808,97 кДж
б) В2О3 + 3Mg = ЗМgО + 2В
![]() (B2O3)= -1264 кДж
(B2O3)= -1264 кДж
![]() (3MgO) = 3*(-601,24) кДж
(3MgO) = 3*(-601,24) кДж
![]() = -1803,72+1264=-539,72 кДж
= -1803,72+1264=-539,72 кДж
в) SiO2 + 2Mg = 2MgO + Si
![]() SiO2 = -859,3 кДж
SiO2 = -859,3 кДж
![]() 2MgO = 2*(-601,24) кДж
2MgO = 2*(-601,24) кДж
![]() = -1202,48+859,3=-343,18 кДж
= -1202,48+859,3=-343,18 кДж
г) ZnO + С = СО + Zn
![]() ZnO = -349 кДж
ZnO = -349 кДж
![]() CO = -110,5 кДж
CO = -110,5 кДж
![]() = -110,5+359=238,5 кДж
= -110,5+359=238,5 кДж
д) МnО2+ 2С = 2СО + Мn
![]() МnО2 = -519,4 кДж
МnО2 = -519,4 кДж
![]() 2СО = 2*(-110,5) кДж
2СО = 2*(-110,5) кДж
![]() = -221+519,4=298,4
= -221+519,4=298,4
e) 3Fe3O4 + 8Al = 4А12О3 + 9Fe
![]() 3Fe3O4 = 3*(-1117,7)=-3353,1 кДж
3Fe3O4 = 3*(-1117,7)=-3353,1 кДж
![]() 4А12О3 = 4*(-1676)=-6704 кДж
4А12О3 = 4*(-1676)=-6704 кДж
![]() = -6704+3353,1=3350,9 кДж
= -6704+3353,1=3350,9 кДж