Химический анализ катионов
Практическая работа №8.
«Составление уравнений окислительно-восстановительных реакций».
Цель работы: закрепить умение решать уравнения окислительно – восстановительных реакций.
Оборудование: разработка п\р.
Перед выполнением практической работы необходимо проработать материал:
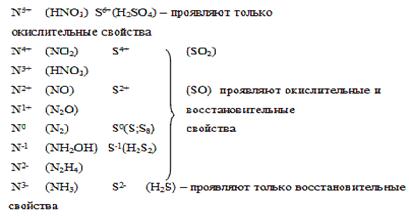
Сущность окисления-восстановления. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Амфотерность
Ход работы


Тема 1.4 Четвертая аналитическая группа катионов
Лабораторная работа №9.
«Проведение частных реакций катионов 4 аналитической группы
(AI3+,Cr3+,Zn2+)»
Цель работы: выявить катионы алюминия, хрома и цинка.
Оборудование: растворы хлоридов алюминия, хрома и цинка, гидроксид натрия, хлорид аммония, раствор нитрата кобальта, сульфат алюминия, раствор Н202, азотная кислота, Сг2(S04)3, 2 М Н2S04, КМn04, раствор К3[Fе(СN)6], раствором нитрата пинка Zn(NO3)2, часовое стекло, пробирки, водяная баня, спиртовка, держатель, проволока, пробирки.
Перед выполнением лабораторной работы необходимо усвоить материал:
Общая характеристика катионов четвертой аналитической группы. Значение катионов четвертой аналитической группы в осуществлении химико-технологического контроля.
Групповой и подгрупповой реактивы и условия их применения. Частные реакции катионов четвертой аналитической группы. Реакции катионов серебра (действие группового реактива – сероводорода, соляной кислоты, хромата калия); свинца (действие группового реактива – сероводорода, соляной кислоты, иодида калия); меди (действие группового реактива – сероводорода, гидроксида аммония, реакция окрашивания пламени).
Ход работы
Опыт №1. Реакции иона алюминия
Реакция с гидроксидом. К 2–3 каплям раствора А1С13 прибавьте 2 капли гидроксида натрия. Растворите осадок в избытке щелочи. Прилейте к полученному раствору равный объем насыщенного раствора NН4С1 и нагрейте реакционную смесь на водяной бане. Что наблюдаете? Напишите уравнения реакций.
Образование тенаровой сини. Возьмите полоску фильтровальной бумаги и смочите ее разбавленным раствором нитрата кобальта Со(N03)2 и раствором сульфата алюминия А12(S04)3. После подсушивания сожгите полоску. Рассмотрите оставшийся пепел, отметьте цвет. Окраска пепла объясняется образованием алюмината кобальта Со(АIO2)2, называемого тенаровой синью. Реакцию следует проводить под тягой.
Опыт №2. Реакции иона хрома.
Реакция с гидроксидом. К 3–4 каплям раствора хлорида хрома СгС13 прибавьте 2 М раствор NаОН до растворения образовавшегося осадка. Обратите внимание на цвет осадка и образовавшегося комплекса. Нагрейте полученный раствор на водяной бане. Что при этом происходит? Напишите уравнения реакций.
Реакция с пероксидом. К 2–3 каплям раствора СгС13 прибавьте 3–4 капли 3‑процентного раствора Н202, затем 4 капли 8 М раствора NаОН. Нагрейте реакционную смесь на водяной бане. Что при этом происходит? Напишите уравнения реакции?
Реакция с перманганатом. Налейте в пробирку по 4–5 капель растворов сульфата хрома Сг2(S04)3, 2 М Н2S04 и КМn04. Нагрейте реакционную смесь в течение нескольких минут на водяной бане. Что наблюдаете?
Опыт №3. Реакции иона цинка.
Реакция с гидроксидом. Поместите в пробирку 2–3 капли раствора ZпС12. Прибавьте каплю раствора щелочи. Напишите уравнение реакции. Растворите осадок в избытке щелочи, затем попытайтесь вновь осадить Zп(ОH)2 прибавлением концентрированного раствора NН4С1. Если осадок гидроксида цинка не образуется, то объясните, почему.
Реакция с гексацианоферратом (II) калия. В две пробирки поместите по 2–3 капли раствора ZпСI2. Затем прибавьте в первую пробирку 2–3 капли раствора К3[Fе(СN)6]. Рассмотрите выпавший осадок.
Получение ринманоевой зелени. Возьмите полоску фильтровальной бумаги и смочите ее раствором нитрата пинка Zn(NO3)2 и разбавленным раствором нитрата кобальта Со(NO3)2. После подсушивания сожгите полоску. Рассмотрите оставшийся пепел. Окраска пепла объясняется образованием цинката кобальта СоZп02, который называют ринмановой зеленью (в ходе реакции также выделяется диоксид азота N02 – газ бурого цвета и газообразный кислород). Реакцию следует проводить под тягой.
Результаты проведенных опытов занесите в таблицу
|
Определяемый |
Среда |
Условия |
Реактив |
Наблю- |
Уравнение |
|
ион |
реакции |
даемое |
реакции | ||
|
явление | |||||
Лабораторная работа №10.
«Анализ смеси катионов 4 аналитической группы»
Цель работы: научиться выявлять катионы 4 группы из смеси.
Оборудование: анализируемый раствор, NаОН, раствора Н2О2, кристаллический NН4С1, 2 М НС1, ализарин, 1 М H 2 SO4, К4 [Fe(CN)6], азот. кислота, смесь эфира с изоамиловым спиртом, водяная баня, спиртовка, хим. стаканчики, стеклянные палочки, пробирки, держатель.
Перед выполнением лабораторной работы необходимо усвоить материал:
Групповой и подгрупповой реактивы и условия их применения. Частные реакции катионов четвертой аналитической группы. Реакции катионов серебра (действие группового реактива – сероводорода, соляной кислоты, хромата калия); свинца (действие группового реактива – сероводорода, соляной кислоты, иодида калия); меди (действие группового реактива-сероводорода, гидроксида аммония, реакция окрашивания пламени). Систематический ход анализа смеси катионов четвертой аналитической группы.
Ход работы
Ход анализа смеси катионов 4 группы обусловлен следующими факторами:
• в результате действия на катионы 4 группы избытка щелочи в присутствии пероксида водорода все ионы переменной степени окисления находятся в растворе в высшей степени окисления; при этом катионы Сг3+ превращаются в.анионы СrO42-;
