Электрофильное ароматическое замещение
2. Дезактивирующие орто-пара-ориентирующие группы. Это галогены F, Cl, Br и I.
3. Дезактивирующие мета-ориентирующие группы. Эту группу составляют NO2, NO, SO3H, SO2R, SOR, C(O)R, COOH, COOR, CN, NR3+ ,CCl3 и др. Это ориентанты II-го рода.
Естественно, что существуют и группировки атомов промежуточного характера, обусловливающие смешанную ориентацию. К ним, например, относятся: CH2NO, CH2COCH3, CH2F, CHCl2, CH2NO2, CH2CH2NO2, CH2CH2NR3+, CH2PR3+, CH2SR2+ и др.
1.2 Электрофильное замещение в π-избыточных гетероциклах
Фуран, пиррол и тиофен обладают значительной реакционной способностью по отношению к обычным электрофильным реагентам. В этом смысле они напоминают наиболее реакционно-способные производные бензола, такие, как фенолы и анилины. Повышенная чувствительность к электрофильному замещению вызвана несимметричным распределением заряда в этих гетероциклах, в результате чего на углеродных атомах цикла имеется больший отрицательный заряд, чем в бензоле. Фуран обладает несколько большей реакционной способностью, чем пиррол, а наименее реакционноспособен тиофен.
1.2.1 Электрофильное замещение пиррола
В то время как пиррол и его производные не склонны к реакциям нуклеофильного присоединения и замещения, они очень чувствительны к электрофильным реагентам, и реакции пирролов с такими реагентами протекают практически исключительно как реакции замещения. Незамещенный пиррол, N- и С-моноалкилпирролы и в наименьшей степени С,С-диалкилпроизводные полимеризуются в сильнокислых средах, поэтому большинство электрофильных реагентов, использующихся в случае производных бензола, не применимы для пиррола и его алкилпроизводных.
Однако при наличии в пиррольном цикле электроноакцепторных групп, препятствующих полимеризации, например, таких, как сложноэфирная, становится возможным использование сильнокислых сред, нитрующих и сульфирующих агентов.
Протонирование
В растворе наблюдается обратимое присоединение протона по всем положениям пиррольного цикла. Наиболее быстро протонируется атом азота, присоединение протона по положению 2 проходит в два раза быстрее, чем по положению 3. В газовой фазе при использовании кислот умеренной силы, таких, как C4H9+ и NH4+, пиррол протонируется исключительно по атомам углерода, причем склонность к присоединению протона по положению 2 выше, чем по положению 3. Наиболее термодинамически стабильный катион - 2Н-пирролиевый ион - образуется при присоединении протона по положению 2 и определяемое значение рКа для пиррола связано именно с этим катионом. Слабая N-основность пиррола обусловлена отсутствием возможности для мезомерной делокализации положительного заряда в 1H-пирролиевом катионе.
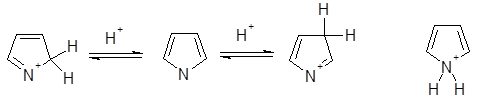
Значение рКа определено для большого числа производных пиррола, а сам незамещенный пиррол — чрезвычайно слабое основание со значением рКа -3,8. Основность пиррольного цикла весьма быстро увеличивается при введении алкильных заместителей, и для 2,3,4,5-тетраметилпиррола рКа равен +3,7, что соответствует полному протонированию всех молекул пиррола в вышеприведенных условиях (для сравнения рКа анилина +4,6). Таким образом, алкильные группы оказывают необычайное стабилизирующее влияние на катионы - пирролы, содержащие трет-бутильные группы, при протонировании образуют стабильные кристаллические соли.
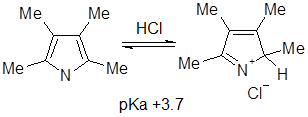
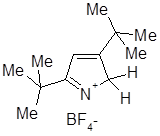
Реакции протонированных пирролов
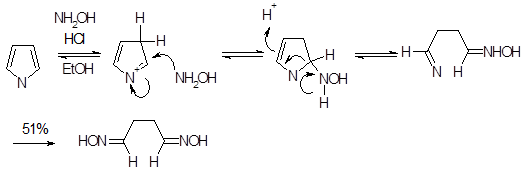
2Н- и ЗН-Пирролиевые катионы в сущности представляют собой иминиевые ионы и, следовательно, обладают свойствами электрофилов. Эти катионы играют ключевую роль в процессах полимеризации и восстановления пирролов в присутствии кислот. При взаимодействии пирролов с гидрохлоридом гидроксиламина, сопровождающимся раскрытием цикла и образованием 1,4-диоксимов, вероятно, образуется более реакционноспособный ЗН-пирролиевый катион. Для защиты аминогруппы первичных аминов могут быть превращены в 1-К-2,5-диметилпирролы, затем защитная группа может быть удалена с помощью описанной выше реакции с гидроксиламином.
Нитрование
Нитрующую смесь, применяемую для нитрования производных бензола, нельзя использовать в случае пиррола, поскольку это приводит к его полному разложению. Однако нитрование пиррола возможно при использовании ацетилнитрата при низких температурах, причем преимущественно образуется 2-нитро-пиррол. Ацетилнитрат получают при смешивании дымящей азотной кислоты с уксусным ангидридом, и в результате образуется уксусная кислота и достигается удаление сильной минеральной кислоты. При нитровании пиррола с использованием ацетилнитрата активность положения 2 в 1,3 • 105, а положения 3 в 3 • 104 раза выше активности бензола.
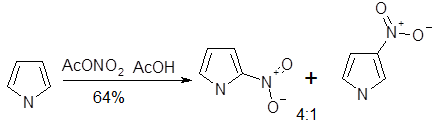
Введение заместителя к атому азота увеличивает долю продукта нитрования по положению 3 в смеси продуктов реакции: так, введение метального заместителя обусловливает получение смеси продуктов β- и α-нитрования в соотношении 1:3. Более объемная трет-бутильная группа приводит даже к обращению относительной реакционной способности — продукты β- и α-нитрования образуются в соотношении 4:1. Полного подавления реакции нитрования по α-положению пиррола можно достигнуть при введение к атому азота триизопропилсилильной (TIPS) группы; использование последней чрезвычайно важно при синтезе 3-производных, так как в последствии она может быть легко удалена.
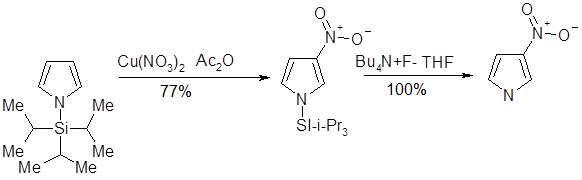
Сульфирование и реакции с использованием других серосодержащих электрофильных реагентов
Для сульфирования пирролов используются мягкие сульфирующие агенты, не обладающие свойствами кислоты; так, комплекс пиридин — триоксид серы мягко превращает пиррол в пиррол-2-сульфонат .
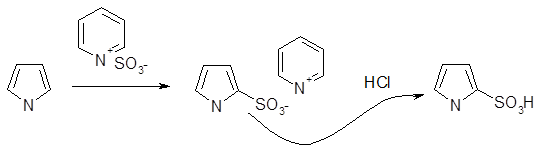
Реакции с использованием других серосодержащих электрофильных реагентов, например сульфинилирование пиррола, тиоцианирование пиррола и 1-фенилсульфоиилпиррола, позволяют получать серосодержащие производные пиррола с атомом серы в более низкой степени окисления.
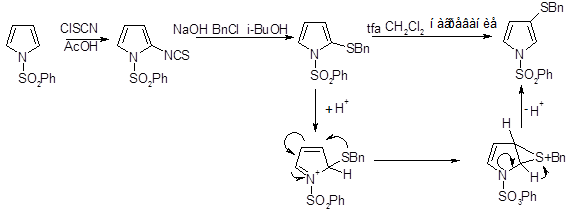
Катализируемая кислотой перегруппировка производных пиррола, содержащих серосодержащий заместитель в α-положении (продукт кинетически контролируемого электрофильного замещения), позволяет получать соответствующие β-изомеры.
Галогенирование
Галогенирование пиррола протекает настолько легко, что, если специальным образом не контролировать течение реакции, образуются исключительно стабильные тетрагалогенопроизводные. Попытки провести моногалогенирование простых алкилпирролов оказались безуспешными, поскольку при этом образуются чрезвычайно реакционноспособные пиррилалкилгалогениды - продукты галогенирования боковой цепи.
