Энергия активации
момент времени в колбе объемом V; х - количество прореагировавших ацетона и иода,
равное количеству вновь образовавшихся оксоний-ионов.
Тогда:
Са = (a-x)/V; С H3O+ = (b+x)/V.(l 9)
Подставляя (19) в (18), находим:
dx/dτ = (K1/V)(a-x)(b+x).
После интегрирования этогоуравнения в пределах от х=0 до х и от τ=0 до х, разрешения относительно K1 получим выражение:
K1 = V/(a+b)τ*In a(b+x)/(a-x)b,(20)
в котором числа моль а и b - заданыусловиями приготовления рабочей смеси, а х в зависимости от τ определяют путем титрования иода тиосульфатом натрия.
Если перейти к концентрациям веществ, участвующих в реакции, то уравнение (20) приобретет вид:
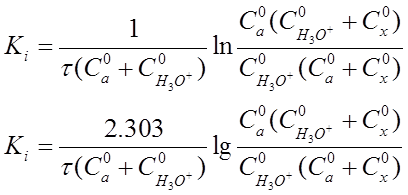 (21)
(21)
где С°а - начальная концентрация ацетона, моль-экв/л;
С H3O+ - начальная концентрация ионов оксония (ионов водорода), моль-экв/л;
Сх - количество прореагировавшего ацетона за время
реакции т, моль-экв/л;
τ - время протекания реакции.
По уравнениям (20) и (21) можно рассчитать константу скорости реакции, используя данные о концентрации веществ, участвующих в реакции.
