Асимметрия мембран
Локализация специфических центров
Ценную информацию иногда можно получить, определяя положение специфических центров в ряде белков. Например, места присоединения сахарных остатков в гликопротеинах плазматической мембраны всегда находятся на ее наружной поверхности, так что выявление их в полипептидной цепи имеет и топологическую ценность. Столь же информативными могут быть и данные о локализации сайтов модификации белка, например сайтов фосфорилирования, если локализация модифицирующего фермента известна. Так, в белках плазматической мембраны фосфорилированные аминокислотные остатки находятся на цитоплазматической стороне. Аналогичным образом может оказаться полезной локализация специфических мест связывания. Например, были идентифицированы места связывания бактериофага с экспонированными на поверхности клетки участками белков ОтрА и LamB наружной мембраны Е. coli; для этого использовались мутантные белки.
Генетические подходы
Возможность генетической модификации мембранных белков привела к созданию новых подходов к их топографическому анализу. Такие методы, по всей вероятности, будут применяться все шире, однако пока число удачных примеров не столь велико, чтобы судить об их надежности и универсальности. Так, в белок ОтрА методами генной инженерии были встроены в определенные места короткие пептиды, затем был проведен протеолиз и по его результатам определено, были ли участки, содержащие включенный пептид, экспонированы на поверхности клетки. Анализ мутантных вариантов позволил идентифицировать также места связывания фага и соответствующие эпитопы в белках, экспонированных на наружной стороне мембраны.
Ценные данные о топографии белков цитоплазматической мембраны Е. coli были получены и с помощью метода гибридизации белков. Гибридные белки можно сконструировать так, что их N-концевой участок будет представлен мембранным белком, а на С-конце будет находиться каталитический центр щелочной фосфатазы. Щелочная фосфатаза обычно локализуется в периплазматическом пространстве Е. coli, куда она транспортируется и где проявляет свою ферментативную активность. Синтез многих мембранных белков, по-видимому, осуществляется линейным образом, начиная с N-конца. Поэтому, если место сочленения, где начинается последовательность щелочной фосфатазы, локализовано на периплаз-матической стороне мембраны, то гибридный белок будет транспортироваться в периплазму и проявлять ферментативную активность. Если же место сочленения находится на цитоплазматической стороне, то щелочная фосфатаза в гибридном белке останется внутри клетки и будет проявлять низкую ферментативную активность. Следовательно, те места сочленения в гибридных белках, которые приводят к высокой активности щелочной фосфатазы, будут соответствовать наружным доменам мембранного белка.
1.2 ПРИМЕРЫ АНАЛИЗА ТОПОГРАФИИ МЕМБРАННЫХ БЕЛКОВ
Один из наиболее ярких примеров детального топографического анализа мембранного белка — это изучение бактериородопсина. Как показывают данные по реконструкции изображения, бактерио-родопсин имеет семь трансмембранных сегментов, по-видимому представляющих собой а-спирали. Результаты протеолиза, химической модификации и связывания антител согласуются с этой моделью, хотя точные границы трансмембранных сегментов не установлены.
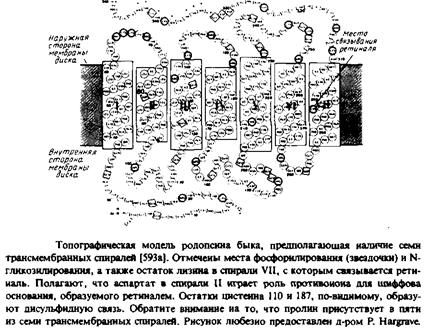
Еще один белок, для которого получены непротиворечивые топографические данные, — это бычий родопсин. В этом случае анализ первичной структуры тоже предполагает наличие семи трансмембранных а-спиралей с соединяющими их петлями. С такой моделью согласуются результаты изучения топографии с помощью антител и протеаз, а также данные о локализации мест фосфорилирования и присоединения углеводов. Обратите внимание, что хотя бактериородопсин и родопсин связывают одну и ту же простетическую группу — ретиналь — и, по-видимому, уложены в мембране одинаковым образом, никакой гомологии в их аминокислотной последовательности не наблюдается и выполняют они разные функции. Бактериородопсин является бактериальным светочувствительным протонным насосом, а родопсин — это зрительный пигмент, содержащийся в палочках сетчатки. Под действием света родопсин претерпевает светозависимые конформационные изменения, инициируя целый каскад событий, конечным результатом которых является зрительный сигнал.
Большое внимание было уделено анализу топографии еще одного трансмембранного белка — ацетилхолинового рецептора. Исходя из анализа первичной последовательности, было предложено несколько топографических моделей этого рецептора, адекватность которых проверялась с помощью иммунологических методов. Следует, однако, отметить, что полученные данные весьма противоречивы; это означает, что применение этих методов не всегда является оправданным.
В качестве последнего примера можно привести микросомный цитохром Ь$. Этот белок функционирует как переносчик электронов, участвуя в некоторых окислительно-восстановительных реакциях в эидоплазматическом ретикулуме. Цнтохром bs — это амфифильный белок, в котором гемсвязывающий каталитически активный домен соединяется с помощью десяти аминокислотных остатков с неполярным доменом — мембранным якорем. Эти два домена можно отделить друг от друга путем проте-олиза. Структуру гемсвязывающего фрагмента изучали методом рентгеноструктуриого анализа. Строение якорного пептида на С-конце белка неизвестно. Топографические исследования, проводившиеся в нескольких лабораториях, были направлены на выяснение одного простого вопроса: пересекает ли этот якорь бислой или он погружен в него только наполовину и, сделав петлю, идет обратно, так что его N- и С-концы оказываются по одну сторону мембраны? Несмотря на все усилия, окончательный ответ на этот вопрос пока не получен. В большинстве исследований использовался очищенный цитохромом bs, встроенный в фосфолипидные везикулы. Проблема состоит в том, что разные методики реконструкции дают разные кон-формации белковой молекулы. При «непрочном» связывании цито-хрома bs С-конец доступен для карбоксипептидазы Y и локализован на той же стороне, что и гемсвязывающий домен. Однако с помощью определенных методик можно получить «прочно» связанный домен, в котором С-конец недоступен для протеолиза, что, вероятно, отвечает топографической ориентации белка in vivo. Корана и др. пытались решить этот вопрос, изучая модификацию двух форм этого белка с помощью фотоактивируемых аналогов фосфолипидов. Они пришли к выводу, что в «прочно» связанной форме белка мембранный якорь пронизывает бис-лой. Этот вывод, однако, не нашел полной поддержки. Другие подходы либо вообще не позволили сделать выбор в пользу той или иной модели, либо дали противоречивые результаты.
Все сказанное выше показывает, что в отсутствие структурных данных высокого разрешения трудно определить способ укладки интегральных белков в мембране. И в самом деле, число белков, для которых это удалось сделать, очень мало.
2. Цитоскелет
В принципе как трансмембранное, так и латеральное распределение мембранных компонентов может зависеть от их взаимодействия со структурами, находящимися на поверхности мембраны. В ряде случаев такая зависимость была четко выявлена, в частности с этим связан все более возрастающий, интерес к взаимодействию мембраны с цитоскелетом. Цитоскелет — это сложная сеть волокон разного типа, обнаруженная в эукариотических клетках. У прокариоти-ческих клеток ничего подобного не выявлено. Основная функция этой системы, по-видимому, связана с механикой клетки. Цитоскелет обеспечивает механическую опору для плазматической мембраны и тем самым определяет форму клетки, а также местоположение клеточных органелл и их перемещение при митозе. С подвижностью внутриклеточных мембранных везикул связаны такие процессы, как эндоцитоз, экзоцитоз и фагоцитоз, а также перемещения плазматической мембраны при амебоидном движении клеток. Все эти процессы осуществляются с участием цитоскелета. По сути цитоскелет является динамическим каркасом клетки, который реагирует как на внутренние, так и на внешние стимулы. Часть этой системы тесно связана с плазматической мембраной. В настоящее время лучше всего охарактеризован мембранный скелет эритроцитов млекопитающих. Менее детально изучены биохимические свойства цитоскелета микроворсинок щеточной каемки кишечного эпителия. Обычно ци-тоскелет представляет собой трехмерную сеть волокон, охватывающую всю клетку. В некоторых точках он прикреплен к плазматической мембране, и эти области, как известно, участвуют в межклеточных контактах или в фокальных контактах, с помощью которых клетки прикрепляются к субстрату в клеточных культурах.
