Асимметрия мембран
6. Гликофорин А. Это основной сиалосодержащий гликопротеин; В отличие от белка полосы 3 он имеет относительно небольшой цитоплазматический домен и один трансмембранный сегмент. Полагают, что этот белок связывается с белком полосы 4.1. Другие его функции неизвестны.
Трансмембранная асимметрия липидов
Мембранные белки, находясь в плоскости бислоя, не меняют Свою топологическую ориентацию. Они встраиваются в мембрану в jCTporo определенной ориентации и остаются в таком положении в течение всего времени их жизни. Липиды ш ряде биологических мембран, напротив, с довольно большой частотой мигрируют с одной стороны мембраны на другую. Определить скорость трансмембранной миграции липидов очень важно по двум причинам: это помогает понять Природу липидной асимметрии и позволяет критически оценить пригодность методов, используемых для нахождения распределения липидов между двумя сторонами бислоя. Чтобы измерения содержа-1кия, например, фосфатидилсерина на наружной стороне мембранных везикул были достоверными, они должны быть завершены до того, как фосфатидилсерин из внутреннего монослоя переместится в наружный. Некоторые методы установления липидной асимметрии модифицируют саму изучаемую систему и индуцируют трансмембранную миграцию липидных молекул, поэтому полученные результаты бывает трудно интерпретировать. Детальная оценка достоинств и недостатков методов изучения липидной асимметрии в мембранах дается, например, в обзорах.
МЕТОДЫ УСТАНОВЛЕНИЯ ТРАНСМЕМБРАННОГО РАСПРЕДЕЛЕНИЯ ЛИПИДОВ
Химическая модификация фосфолипидов
Относительно легко подвергаются химической модификации только аминофосфолипиды, например фосфатидилсерин и фосфати-дилэтаноламин. При этом мембранный препарат с известной топологической ориентацией обрабатывают реагентом, который не проникает через бислой и ковалентно связывается со свободными аминогруппами тех аминофосфолипидов, которые находятся только на наружной поверхности мембраны. Чаще всего с этой целью используют ТНБС. Доля фосфатидилэтаноламина, вступившего в реакцию, должна служить мерой его содержания на наружной стороне мембраны. Очевидно, однако, что такой вывод неправомочен, если реакция не доходит до конца или если в ходе реакции значительное количество фосфатидилэтаноламина перемещается с внутренней стороны мембраны на наружную и становится доступным для реагента. Как правило, в реальной ситуации имеют место оба обстоятельства, что значительно осложняет интерпретацию результатов.
Предложен вариант этого подхода, предусматривающий синтез аналогов фосфолипидов с реакционноспособными сульфгидрильны-ми группами с последующим использованием непроникающих реагентов, избирательно реагирующих по SH-группам. Естественно, что эти липидные аналоги следует включать в изучаемые мембраны перед обработкой реагентами, и желательно предварительно исследовать их поведение в модельных системах.
Фосфолипидный обмен
Спонтанный обмен фосфолипидами между мембранами, как правило, протекает с пренебрежимо малой скоростью. Однако были выделены белки, называемые липидпереносящими белками, которые катализируют обмен. Эти белки чаще всего выделяют из тканей млекопитающих. Наиболее изучен белок из печени крысы, который обладает абсолютной специфичностью по отношению к фосфатидилхолину и катализирует его обмен между мембранами. Большинство других липидперенося-щих белков менее специфичны к полярным головкам липидных молекул. Это растворимые белки, которые имеют высокоаффинные места связывания фосфолипидных молекул. Механизм обмена неизвестен, однако ЛПБ можно использовать для изучения липидной асимметрии, поскольку они связывают липиды только наружной поверхности бислоя, с которыми они контактируют. Обычно мембранные везикулы инкубируют с избытком липосом, содержащих радиоактивно меченный фосфолипид, в присутствии липидперенося-щего белка. Фосфолипидный обмен со стехиометрией 1:1, который катализируется указанными белками, не приводит к изменению состава мембран, при этом степень обмениваемости фосфолипидов можно определить, измерив удельную радиоактивность мембраны. Если фосфолипид в мембране полностью доступен для обмена, то его удельная радиоактивность в липосомах и мембранах в конце эксперимента будет одинаковой. Если же изучаемый липид на внутренней стороне мембраны недоступен для обмена, то его удельная радиоактивность в мембране будет ниже, чем в липосомах. Если трансмембранная миграция протекает медленнее, чем устанавливается равновесие при обмене, то удельная радиоактивность будет возрастать во времени, и это возрастание будет отражать скорость флип-флопа. При проведении этих экспериментов необходимо отделять липосомы от изучаемых мембран; для этого обычно используют центрифугирование.
Достоинство этой методики состоит в том, что ЛПБ не проникают через мембрану, недостаток же связан с тем, что равновесие устанавливается медленно, за несколько часов или даже больше. Поэтому данная методика неприменима, когда происходит быстрая трансмембранная миграция, но ее можно использовать в сочетании с другими методами. Например, можно провести обмен радиоактивных липидов, находящихся на наружной поверхности бислоя, а затем использовать фосфолипазы для оценки скорости, с которой эти липи-ды мигрируют с наружной стороны мембраны на внутреннюю.
Фосфолипазы
Фосфолипазы — это ферменты, гидролизующие фосфолипиды по связям, указанным на рис. 4.3. Фосфолипазы представляют собой
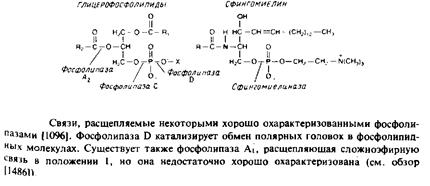
растворимые белки, которые взаимодействуют только с наружной поверхностью бислоя и поэтому являются ценным инструментом для изучения асимметрии фосфолипидов и скорости их трансмембранной миграции. При работе с фосфолипазами следует иметь в виду два момента: 1) не все фосфолипиды на наружной стороне мембраны легко вступают в реакцию; 2) продукты реакции обычно дестабилизируют бислой. Даже если при действии фосфолипаз целостность бислоя не нарушается, скорость трансмембранной миграции фосфолипидов может существенно возрасти. Поэтому ход реакции необходимо тщательно контролировать, а выводы, сделанные на основании полученных результатов, — критически анализировать.
Другие методы
Для установления трансмембранного распределения липидов были предложены и другие специальные методы. Рассмотрим некоторые из них.
1.Распределение кардиолипина можно определить по специфичному связыванию с ним адриамицина.
2.Распределение гликолипидов можно определить, окисляя их либо галактозооксидазой, либо периодатом натрия с последующим восстановлением 3Н-боргидридом натрия.
3.Распределение стеролов можно определить несколькими методами. Стеролы могут самопроизвольно обмениваться между мембранами даже без участия особых белков. Поэтому их присутствие в наружном монослое мембраны можно определить по переносу в липосомы или из липосом. Распределение холестерола между двумя сторонами мембраны устанавливали, изучая кинетику образования комплекса между ним и филипином. Наконец, для определения содержания холестерола в наружном монослое мембраны использовали холестеролоксидазу, однако возникающие при этом артефакты ставят возможность применения этого фермента под сомнение.
