Источники и пути образования оксида азота в организме
Накопленные к настоящему времени основные сведения о роли NO в регуляции функциональной активности гепатоцитов можно суммировать следующим образом.
1. Влияние NO на синтез белка. В условиях генерации NO наблюдается ингибирование синтеза белка в гепатоцитах в культуре. Механизм такого ингибирования остается неясным. Он не обусловлен возможной потерей жизнеспособности клеток или высвобождением гепатоцеллюлярных ферментов. Блокада белкового синтеза в гепатоцитах осуществляется по цГМФ-независимому пути. Однако в экспериментах на животных in vivo было показано усиление синтеза белка в гепатоцитах на септической модели в условиях экспрессии NO-синтазы. Вопрос о влиянии NO на синтез белка нуждается в дальнейшем изучении.
2. Ингибирование глюконеогенеза и гликогенеза. Поскольку доноры NO подавляют гликогенолиз в печени животных, можно говорить о регулирующем влиянии NO на гомеостаз глюкозы. На септических моделях наблюдается ингибирующее влияние NO на процессы глюконеогенеза.
3. Активация растворимой гуанилатциклазы. NO вызывает накопление цГМФ в гепатоцитах животных, но в целом роль цГМФ в физиологии гепатоцитов еще не изучена.
4. Влияние NO на систему цитохрома Р-450. как известно, одной из важнейших функций печени является метаболизм ксенобиотиков, осуществляемый локализованными в микросомах гепатоцитов монооксигеназами со смешанной функцией, объединяемыми общим названием цитохромов Р-450. к ксенобиотикам относятся разнообразные лекарственные средства, токсины, канцерогены и другие чужеродные для организма соединения. Было показано, что NO способен не только ингибировать активность цитохромов Р-450, но и подавлять их экспрессию при воспалении. Действие специфично к отдельным изоферментам цитохрома Р-450. наблюдаемое в клинике изменение метаболизма ряда лекарственных и токсических соединений в печени при некоторых системных воспалительных процессах связано в первую очередь с активностью NO [5].
Влияние NO на печень не ограничивается септическими состояниями. Имеются сведения о важной роли NO в функциональных сдвигах, наблюдаемых в печени при ишемии и реперфузии, злокачественных новообразованиях, циррозе и ряде др. патологических состояний [12].
В медицинском плане более перспективными представляются способы регуляции NO с помощью специфических ингибиторов отдельных форм NO-синтаз и доноров NO, способных избирательно воздействовать на клетки и ткани. К сожалению, синтезируемые к настоящему времени специфичные ингибиторы, например N5-(1-имно-3-бутенил)-L-орнитин, не обладают абсолютной избирательностью. Одной из перспективных мишеней противовоспалительной терапии может оказаться ядерный фактор транскрипции NFkB. Однако при любом подходе к решению проблемы регуляции NO необходимо иметь в виду, что NO – вездесущий медиатор метаболизма и резкое изменение его генерации может привести к нарушению функциональной активности многих биосистем [5].
Фармакологические возможности регуляции содержания окиси азота в организме
Уникальные биологические свойства NO и его участие в разнообразных физиологических и патофизиологических процессах дают основания для использования данного соединения (путем управления его содержанием) в профилактических и лечебных мероприятиях. Существуют следующие способы изменения содержания NO, вытекающие из данных о L-аргинин-NO-метаболизме:
· регуляция уровня субстрата (L-аргинина);
· активация/индукция/ингибирование NO-синтаз;
· защита или инактивация NO.
Кроме того, в качестве терапевтических средств могут применяться экзогенные доноры NO или само соединение в виде компонента газовой смеси.
В последнее время были получены новые сведения о механизмах действия фармакологических агентов, известных как нитровазодилататоры (НВД). Оказалось, что существенная доля вызываемых ими биологических эффектов связана метаболическими превращениями органических нитратов в организме, сопровождающимися выделением NO. Во многих случаях эти препараты, по-видимому, заменяют эндогенные источники NO в организме, дефектные при патологических состояниях. На эффективность выделения NO из НВД влияет присутствие низкомолекулярных тиолов (наиболее активен цистеин). Многими исследователями продемонстрировано также антитромботическое действие НВД, которое развивается параллельно с релаксацией гладкой мускулатуры сосудов и также требует в отдельных случаях присутствия тиолов. Очевидно, что понимание механизмов действия NO в организме необходимо при разработке новых препаратов – доноров NO для преодоления индуцироемой нитратами резистентности сосудов к релаксации или эндотелиальной дисфункции, сопровождающей многие заболевания (атеросклероз, гипертонию, диабет и др.) [1].
Основные стадии синтеза NO, через которые возможна регуляция содержания NO в организме, представлены ниже.
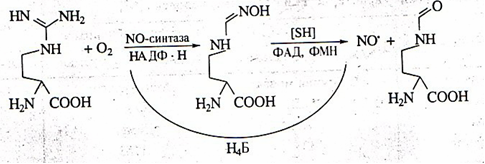
Рис. 9. Схема синтеза оксида азота из L-аргинина.
Перспективность использования L-аргинина как полузаменимой аминокислоты в терапии ряда патологий известна давно: дефицит аргинина приводит к дисфункции семенников, экзогенный аргинин оказывает защитное действие при гипероксии, гипотермии, поражении печени, повышает уровень инсулина и соматотропного гормона, ускоряет отторжение трансплантата, регрессию экспериментальных опухолей [13]. Однако в какой степени достигаемые эффекты (снижение артериального давления, коррекция эндотелиальной дисфункции при гиперхолистеринемии, терапия гломерулонефрита) опосредуются через NO, остается пока невыясненным. Снижение содержания аргинина в организме возможно также с помощью фермента аргиназы, превращающей его в орнитин. О возможности управления содержанием NO через модуляцию уровня кофакторов NO-синтаз свидетельствуют данные об индукции ее образования в изолированных сосудах ингибитором синтеза тетрагидроптерина – 2,4-диамино-гтдроксипиримидином.
Широкое применение в экспериментальных исследованиях нашли различные ингибиторы NO-синтаз. Однако необходим дальнейший поиск агентов, подавляющих синтез NO (например, анестетики), с приемлемыми фармакологическими характеристиками. Те же требования могут быть предъявлены и к активаторам синтеза NO, среди которых агонисты, иммуномодуляторы и др. содержание самого NO может модулироваться уровнем супероксидрадикала или других перехватчиков: железосодержащих соединений, гемоглобина. Окись азота уже испытана в качестве терапевтического агента при различных заболеваниях легких) гипертония, астма и др.) [1].
Заключение
Таким образом, образование NO при ферментативном окислении L-аргинина является уникальным биохимическим феноменом. Эксперименты на животных показали его чрезвычайно важную роль в регуляции сосудистого тонуса, активности тромбоцитов и лейкоцитов, нейропередаче и нейромодуляции, в обеспечении толерантности организма к патогенам. Некоторые из этих функций NO начинают успешно использоваться в терапии ряда заболеваний легких, сосудов, мозга [1]. Применение уже известных фармакологических средств и разработка новых для воздействия на физиологические и патофизиологические процессы, опосредуемые оксидом азота, несомненно, приведет к значительному прогрессу в лечении таких распространенных заболеваний, как атеросклероз, гипертония, диабет и др. Кроме того, следует учитывать биологические явления, связанные с NO, при изучении побочных эффектов традиционных терапевтических препаратов, а также вновь разрабатываемых средств для применения в иных областях медицины [1].
