Источники и пути образования оксида азота в организме
Одним из самых важных кофакторов является внутриклеточный кальцийсвязывающий белок кальмодули. При повышении содержания ионов кальция в клетке он присоединяется к молекуле NO-синтазы, что приводит к активации фермента и синтезу NO (слайд 2). Такое свойство фермента имеет большое значение для клеток, поскольку ферментативная активность, а значит, и синтез NO прямо зависят от функционального состояния клетки, определяющегося во многом внутриклеточным уровнем ионов кальция – высокоактивных посредников, влияющих на многие процессы в клетках. Среди других регуляторных механизмов фермента следует отметить возможность фосфорилирования белковой части молекулы и влияние особых белков, участвующих в связывании двух субъединиц фермента в единый функционально активный комплекс [2].
Активность конститутивных (т.е. нейрональная и эндотелиальная) изоформ фермента прямо зависит от внутриклеточной концентрации ионов кальция или кальмодулина и, таким образом, повышается под влиянием различных агентов, приводящих к увеличению их уровня в клетке. Конститутивные изоформы NO-синтазы имеют преимущественно физиологическое значение, поскольку количество образуемого NO относительно невелико [2].
Индуцибельные (т.е. макрофагальные) изоформы NO-синтазы проявляют активность через некоторое время (как правило, 6-8ч – время, необходимое для активации генов и начала синтеза фермента) после внешнего воздействия на клетки, продуцируют огромные (в 100-1000 раз больше, чем конститутивные изоформы фермента) количества NO. Поскольку высокие дозы NO токсичны для клеток, эта форма фермента считается патологической в отличие от конститутивной. Активность индуцибельной NO-синтазы не зависит от уровня кальция/кальмодулина, поскольку, как полагают, кальмодулин постоянно и прочно связан с ферментом [2].
Локализация NO-синтазы
В настоящее время показано, что не только макрофаги, но и многие другие клетки (нейтрофилы, гепатоциты, гладкомышечные клетки, клетки астроглии) способны при определенных внешних воздействиях, в основном в условиях патологии, синтезировать индуцибельную изоформу NO-синтазы. Нейрональная NOS обнаружена не только в нервных клетках, но и в скелетных мышцах. Эндотелиальная NOS обнаружена в эндотелиальных клетках, клетках эпителия и кардиомиоцитах. Нейрональная и макрофагальная формы фермента находятся в клетках преимущественно в растворенном состоянии – в цитозоле, а эндотелиальная NO-синтаза обычно связана с клеточными мембранами [2].
N-концевая последовательность NOS подвергается миристоилированию и пальмитоилированию, что определяет ее субклеточную локализацию и косвенно ее активность. Так, для фиксации эндотелиальной NOS в плазматической мембране необходимо ацилирование N-терминальных остатков глицина в молекулах фермента с образованием амидных связей [3].
Нейрональная изоформа NOS связана с мембраной за счет взаимодействия N-концевого PDZ-фрагмента с белками типа PSD-95, PSD-93 и дистрофинсвязанным белком – синтрофином [3].
В отличие от конститутивных изоформ, индуцибельная NOS, не связанная с мембранными белками, является цитозольным ферментом [3]. Однако сравнительно недавно в митохондриях была выявлена конститутивно экспрессируемая NO-синтаза. По основным характеристикам митохондриальная NOS сходна с макрофагальной [16]. Сравнивая скорости продукции NO интактными митохондриями, митохондриальным гомогенатом и субмитохондриальными частицами (1.4, 4.9 и 7.1 нмоль/мин на мг белка соответственно) можно сделать вывод, что mtNOS фиксирована на внутренней мембране митохондрий, тогда как iNOS является цитозольным ферментом. Вопрос о том, что представляет собой митохондриальная NOS – отдельную изоформу фермента или же модифицированную во время трансляции или после нее индуцибельную NOS (как это имеет место в скелетных мышцах для нейрональной) – остается открытым [3].
Таблица 1. Физико-химические характеристики NO-синтаз человека[1].
|
Характеристика |
Изоформа NO-синтазы | ||
|
Нейрональная |
Индуцируемая |
Эндотелиальная | |
|
Источник выделения белка Молекулярная масса Нативная структура Аминокислотная длина Локализация в клетке Локализация в геноме |
Нейроны мозга 160кДа Димер 1433 Цитозоль Хромосома 12 |
Макрофаги 130кДа Димер 1153 Цитозоль Хромосома 17 |
Эндотелий сосудов 133 кДа Нет данных 1203 Мембрана, цитозоль Хромосома 7 |
Регуляция активности NOS
В процессе образования NO флавин редуктазы принимает электроны с НАДФ*Н и переносит их на железо гемовой группы. В результате этой реакции образуется активированная молекула О2, необходимая для синтеза NO. В эндотелиальной NOS и нейрональной NOS перенос электронов с флавина на гемм инициируется связыванием СаМ соответствующим сайтом фермента., т.е. СаМ участвует в регуляции продукции NO этими конститутивными NOS [3].
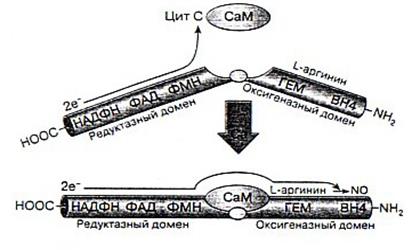
Рис.3. Схематическое представление синтеза NO и регуляции работы NO-синтазы[2].
Считается, что механизм активирующего действия СаМ на нейрональную NOS обусловлен изменением конформации редуктазного домена при связывании этого белка, что, в свою очередь, приводит к повышению скорости переноса электронов как на флавины, так и на конечные акцепторы электронов. Показано, что при этом СаМ активирует выраженные, происходят и при связывании СаМ эндотелиальной формой NOS. В отличие от нейрональной и эндотелиальной NOS, индуцибельная связывает редуктазный домен независимо от домена оксигеназы. Такие же изменения, но менее СаМ практически необратимо, что проявляется длительной продукцией NO этим ферментом [3].
Таким образом, нейрональная и эндотелиальная NOS неактивны при нормальном уровне Са2+ в клетке и начинают синтезировать NO в ответ на увеличение концентрации кальция в цитозоле, вызывающее связывание СаМ этими конститутивными ферментами. Длительное повышение уровня кальция приводит к постоянной продукции NO. Напротив, продукция индуцибельной формой NOS не зависит от уровня внутриклеточного кальция и при нормальном его уровне лимитирована только количеством фермента и субстрата и наличием кофакторов [3].
Один из механизмов регуляции продукции NO – фосфорилирование молекулы NO-синтазы. Фосфорилирование конститутивных NOS цАМФ-зависмой протеинкиназой, протеинкиназой С, цГМФ-зависимой протеинкиназой, Са2+-кальмодулинзависимой протеинкиназой ведет к снижению активности этих ферментов. С другой стороны, протеинфосфатаза-кальцийнейрин может дефосфорилировать NOS, вызывая тем самым повышение ее каталитической активности [3].
