Жидкие растворы
![]()
5. Нормальная концентрация (или нормальность).
Определяется отношением числа эквивалентов растворенного вещества B к объему раствора, выраженному в литрах. Физический смысл нормальной концентрации заключается в том, что она указывает на число эквивалентов растворенного вещества, содержащегося в 1 литре раствора.
![]()
6. Моляльная концентрация (или моляльность).
Определяется отношением числа молей растворенного вещества к массе растворителя. Физический смысл заключается в том, что она показывает, сколько молей вещества растворено в 1 кг (1000г) растворителя.
![]()
Применение того или иного способа выражения концентрации зависит от решения конкретных практических задач.
V. Растворимость. Зависимость растворимости от температуры.
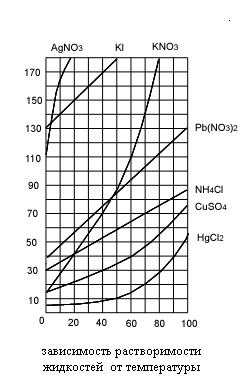 Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество мало растворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество мало растворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает.
Растворение большинства твердых веществ в жидкостях сопровождается обычно поглощением энергии. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого вещества. В этом случае растворимость твердых веществ увеличивается с ростом температуры. Но если растворение сопровождается выделением энергии, то растворимость с ростом температуры понижается. Такое явление наблюдается при растворении в воде щелочей, солей лития, магния, алюминия.
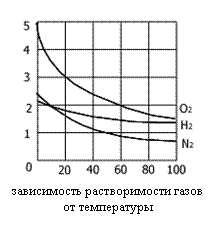 Теоретически пока нельзя вычислить точно величину растворимости данного вещества в определенном растворителе. Сходство в химической природе двух веществ увеличивает их взаимную растворимость. Многие жидкости проявляют способность к неограниченной взаимной растворимости. Так бензол и толуол, вода и этиловый спирт могут смешиваться друг с другом в любых отношениях. Жидкости с ограниченной взаимной растворимостью образуют расслаивающиеся системы. По мере повышения температуры взаимная растворимость увеличивается, и тогда жидкости полностью смешиваются, образуя однородную массу. Температура, при которой наступает смешивание, называется критической температурой смешения. Растворение газов в воде представляет собой экзотермический пресс. Поэтому растворимость газов с повышением температуры уменьшается. Однако растворение газов в органических жидкостях сопровождается поглощением теплоты. Это происходит от того энергия межмолекулярного взаимодействия между молекулами растворителя и растворимого вещества больше, чем энергия притяжения между молекулами газа и растворителя в растворе.
Теоретически пока нельзя вычислить точно величину растворимости данного вещества в определенном растворителе. Сходство в химической природе двух веществ увеличивает их взаимную растворимость. Многие жидкости проявляют способность к неограниченной взаимной растворимости. Так бензол и толуол, вода и этиловый спирт могут смешиваться друг с другом в любых отношениях. Жидкости с ограниченной взаимной растворимостью образуют расслаивающиеся системы. По мере повышения температуры взаимная растворимость увеличивается, и тогда жидкости полностью смешиваются, образуя однородную массу. Температура, при которой наступает смешивание, называется критической температурой смешения. Растворение газов в воде представляет собой экзотермический пресс. Поэтому растворимость газов с повышением температуры уменьшается. Однако растворение газов в органических жидкостях сопровождается поглощением теплоты. Это происходит от того энергия межмолекулярного взаимодействия между молекулами растворителя и растворимого вещества больше, чем энергия притяжения между молекулами газа и растворителя в растворе.
На практике растворимость вещества выражается величиной, называемой коэффициентом растворимости. Коэффициент растворимости показывает массу вещества, насыщаемую при данной температуре 100 граммов растворителя.
Растворимость некоторых веществ в воде представлена в таблице
|
Вещество |
Растворимость: масса вещества (г) в 100 г воды при температурах | ||||||
|
00C |
100C |
200C |
400C |
600C |
800C |
1000C | |
|
SO2 |
22,83 |
16,21 |
11,29 |
5,41 |
3,2 |
2,1 |
– |
|
NH3 |
89,7 |
68,3 |
52,9 |
31,6 |
16,8 |
6,5 |
0 |
|
CuSO4 |
14,3 |
17,4 |
20,7 |
28,5 |
40,0 |
55,0 |
75,4 |
|
K2SO4 |
7,35 |
9,22 |
11,11 |
14,76 |
18,17 |
21,4 |
24,1 |
|
Al2(SO4)3 |
31,2 |
33,5 |
36,4 |
45,7 |
59,2 |
73,1 |
89,0 |
|
NaCl |
35,7 |
35,8 |
36,0 |
36,6 |
37,3 |
38,4 |
39,8 |
|
NH4Cl |
29,4 |
33,3 |
37,2 |
45,2 |
55,2 |
65,6 |
77,3 |
|
KNO3 |
13,3 |
20,9 |
31,6 |
63,9 |
110,0 |
169 |
243 |
|
KNO2 |
278,8 |
– |
298,4 |
334,9 |
350 |
376 |
412,9 |
VI. Теплоты растворения и разбавления.
Изменение энтальпии при переходе твердого, жидкого или газообразного вещества в раствор называется теплотой или энтальпией растворения. Эндотермические реакции характеризуются положительным изменением энтальпии, а экзотермические – отрицательным. Энтальпией растворения называют изменение энтальпии при растворении 1 моль вещества в некотором количестве чистого растворителя. Процесс растворения в термохимии обычно выражают термохимическим уравнением, например процесс растворения a моль Pb(NO3)2 в b моль воды можно представить уравнением:
![]()
