Жидкие растворы
![]()
где С1B и С2B - концентрации растворенного вещества в первом и втором растворителях;
KD(B) – константа распределения вещества B между двумя жидкими несмешивающимися фазами.
VIII. Неидеальные растворы.
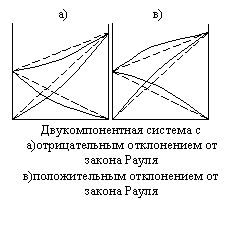
Реальные растворы в подавляющем большинстве не подчиняются законам идеальных растворов. Очень многие из них не подчиняются, например, закону Рауля, причем известны как положительные, так и отрицательные отклонения. Если давление пара над реальным раствором больше, чем над идеальным такого же состава, то отклонения от закона Рауля называют положительными, а если меньше, то отрицательными. Знак и величина отклонения зависит от природы растворителя и растворенного вещества. . Если молекулы одного компонента сильнее притягиваются друг к другу, чем к молекулам другого компонента, то парциальные давления пара над смесью будут больше вычисленных. Если же частицы разных компонентов притягиваются друг к другу сильнее, чем частицы одного и того же компонента, то парциальные давления будут меньше вычисленных.
В реальных растворах взаимодействия между однородными и разнородными молекулами различны. Если раствор образуется из частных компонентов А и В, то изменение потенциальной энергии при образовании раствора равно:
 DU=
DU=![]() , где
, где
UA-A, UB-B и UA-B - средние потенциальные энергии взаимодействия между однородными и разнородными молекулами соответственно, если DU=0, то раствор идеальный. Идеальные растворы при всех концентрациях и температурах подчиняются закону Рауля.
IX. Активность и коэффициент активности.
При рассмотрении термодинамических свойств растворов принято пользоваться отношением
![]()
Эта величина называется активностью i в растворе. Согласно уравнению ![]() отношение
отношение![]() равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов .раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:
равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов .раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:
![]()
Вместо активности нередко пользуются величиной коэффициента активности, g. Он равен отношению активности к концентрации g=![]() . Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.
. Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.
X. Кристаллизация растворов.
Раствор, в отличие от чистой жидкости не отвердевает целиком при одной температуре. Кристаллы начинают выделяться при какой-то одной температуре. По мере понижения температуры количество их растет, пока весь раствор не отвердеет. Температурой начала кристаллизации называют температуру, при которой при охлаждении раствора начинается образование кристаллов. Не рассматривая здесь систем, в которых происходит образование твердых растворов, можно сказать, что температурой начала кристаллизации называется температура, при которой кристаллы растворителя находятся в равновесии с раствором данного вещества. Опыт показывает, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Такое изменение температуры можно рассматривать как общее правило. Для характеристики температуры замерзания раствора введена величина “понижение температуры замерзания” DT 3. Она определена как разность между температурами замерзания чистого растворителя и раствора:
DT3=![]() .
.
Понижение температуры замерзания пропорционально концентрации растворенного вещества в растворе.
DT=K*c
Коэффициент K называется молярным понижением температуры замерзания или криоскопической постоянной. К = 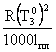 , где
, где
![]() -температура замерзания растворителя
-температура замерзания растворителя
lпл – удельная теплота плавления
XI. Кипение растворов.
Если рассматривать растворы нелетучего вещества в летучих растворителях, то температура кипения таких растворов всегда выше температуры кипения чистого растворителя. Повышение температуры кипения будет тем больше, чем выше концентрация раствора. И для разбавленных растворов его можно считать пропорциональным концентрации. Для растворов температуры кипения являются более высокими, чем для чистого растворителя и разность между ними
DТкип = T кип - ![]()
будет тем большей, чем выше концентрация растворов. Повышение температуры кипения пропорционально концентрации раствора.
DT кип = Е*с
Коэффициент пропорциональности Е является постоянной. Он называется молярным повышение температуры кипения или эбуллиоскопической постоянной. Е = 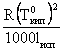 , где
, где ![]() - температура кипения чистого растворителя
- температура кипения чистого растворителя
lисп – удельная теплота его испарения
XII. Осмос.
Раствор представляет собой гомогенную систему. Все частицы растворенного
вещества находятся в беспорядочном тепловом движении равномерно распределены по всему объему раствора.
Если поместить в сосуд концентрированный раствор какого-либо вещества, например, сахара, а поверх его осторожно налить слой более разбавленного раствора сахара, то вначале сахар и вода будут распределены в объеме раствора неравномерно. Но через некоторое время молекулы сахара и воды вновь равномерно распределяться по всему объему жидкости. Это происходит потому, что молекулы сахара, беспорядочно двигаясь проникают как из концентрированного раствора в разбавленный, и в обратном направлении, но при этом в течение любого промежутка времени из концентрированного раствора переходит в разбавленный раствор больше молекул, чем из разбавленного в концентрированный. Точно так же ведут себя и молекулы воды. Таким образом возникает направленное движение молекул сахара из концентрированного раствора в разбавленный, а воды – из разбавленного раствора в концентрированный. Такой самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации, называется диффузией. Когда концентрация раствора во всем его объеме выравнивается, диффузия прекращается. В рассмотренном случае частицы растворителя и растворенного вещества диффундируют в противоположных направлениях. Такой процесс называется двусторонней или встречной диффузией. Но возможен и другой случай, когда между веществами поместить перегородку, через которую растворитель проходить может, а растворенное вещество нет. Односторонняя диффузия вещества через такую перегородку называется осмосом.
