Жидкие растворы
Теплота растворения зависит от концентрации полученного раствора и от температуры.
Особый интерес представляют первая и полная теплоты растворения. Первой теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в бесконечно большом количестве растворителя. В результате этого процесса образуется бесконечно разбавленный раствор. Полной теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в таком количестве чистого растворителя, которой необходимо для образования насыщенного раствора.
Тепловой эффект взаимодействия раствора данной концентрации с чистым растворителем называется энтальпией разведения или разбавления. Если раствор, содержащий 1 моль растворенного вещества, разбавляется от данной концентрации до определенной конечной (не бесконечно малой) концентрации, то тепловой эффект тепловой эффект называется промежуточной теплотой разбавления.
VII. Давление пара растворов. Состав пара растворов.
Давление насыщенного пара является весьма важным свойством растворов. С его величиной непосредственно связаны многие свойства растворов. Допустим, что к пару применимы законы идеальных газов. Воспользуемся упрощенной схемой испарения. Растворяя большое количество какого-либо вещества в данном растворителе, мы понижаем концентрацию молекул последнего в единице объема и уменьшаем этим число молекул, вылетающих в единицу времени из жидкой фазы в газообразную. В результате равновесие между жидкостью и паром устанавливается при меньшей концентрации раствора, т.е. при меньшем его давлении. Следовательно, давление насыщенного пара растворителя над раствором, должно быть всегда меньше, чем над чистым растворителем. При этом понижение давления пара будет, тем больше чем больше концентрация растворенного вещества в растворе. Из этого вытекает закон Генри, который можно выразить уравнением:
![]() , где
, где
![]()
p – парциальное давление
k – константа Генри
Закон Генри звучит так: Парциальное давление пара растворенного вещества пропорционально его концентрации в растворе.
При NA=1 парциальное давление пара pA представляет собой давление насыщенного данного компонента в свободном состоянии ![]() . Следовательно k=
. Следовательно k=![]() и равенство принимает вид:
и равенство принимает вид:
![]()
Концентрация растворенного вещества в растворе при выражении ее в мольных долях этого вещества NA связана с концентрацией растворителя как
NA+ NB =1. Подставляя это выражение в закон Генри получим:
![]() Þ
Þ
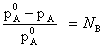
Разность (![]() ) называется понижением давления насыщенного пара, а отношение
) называется понижением давления насыщенного пара, а отношение ![]() -относительным понижением давления насыщенного пара.
-относительным понижением давления насыщенного пара.
Согласно закону Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле вещества в растворе
Если графически изобразить зависимость давления пара каждого вещества двухкомпонентной смеси от его мольной доли, поучиться прямая линия. Пусть даны вещества А и В. Обозначим их мольные доли NA и NB. По закону Рауля имеем:
 pA=
pA=![]() * NA, pB=
* NA, pB=![]() * NВ
* NВ
 где p0 есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли.
где p0 есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли.
Для общего давления пара раствора отсюда следует равенство: p=![]() * NA +
* NA + ![]() * NВ
* NВ
Эта линейная зависимость осложняется если между компонентами смеси действуют силы притяжения, и она изображается не прямой, а кривой линией
Если оба компонента раствора в чистом состоянии летучи, то пар будет содержать оба компонента. Однако относительное содержание компонентов в парах в общем случае будет отличаться от относительного содержания их в жидкостях. Для простейших систем легко установить соотношение между составами раствора и пара, равновесного с ним. Только b системе, компоненты которой обладают одинаковым давлением пара в чистом состоянии, состав пара над раствором равен составу раствора. В остальных же случаях состав пара отличен от состава раствора и тем в большей степени, чем больше различаются давления пара над чистыми компонентами. В простейших системах в парах всегда преобладает по сравнению с жидкостью тот из компонентов, который обладает большим давлением пара в чистом состоянии.
В количественной форме соотношения между составом пара и жидкости могут быть выведены следующим путем. Обозначим через NA’ и NB’ мольные доли компонентов в парах, причем NA’=![]() и NB’=
и NB’=![]()
Пользуясь законом Рауля легко получить, что p=![]() , а пользуясь выражением p=
, а пользуясь выражением p=![]() получаем, что
получаем, что ![]() =
=![]()
Для систем, в которых зависимость давления пара от состава нелинейная, нет общего выражения, в такой простей форме связывающего составы пара и раствора. Зависимость состава пара от состава раствора и общего давления характеризуется законом, открытым Д.И.Коноваловым и носящими его имя. Закон Коновалова характеризует соотношения между составами равновесных жидкостей и пара и влияние добавления того или иного компонента на общее давление пара. Он формулируется следующим образом:
а) Повышение относительного содержания компонента в жидкой фазе всегда вызывает увеличение относительного содержания его и в парах.
b) В двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно более богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении.
Введем в раствор из двух веществ какое-либо новое вещество. В общем случае это вещество распределится между обоими веществами в растворе, пропорционально своей растворимости в каждом из них. Отсюда втекает закон распределения, согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества.
