Процессы и аппараты в химической технологииРефераты >> Технология >> Процессы и аппараты в химической технологии
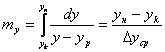 - ЧЕП для паровой и жидкой фазы; где
- ЧЕП для паровой и жидкой фазы; где ![]() - изменение концентрации в
- изменение концентрации в
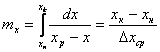 фазе G,L в результате массообмена фаз на поверхности
фазе G,L в результате массообмена фаз на поверхности ![]() ,
, ![]() -
-
движущая сила на этой поверхности.
ЧЕП – это изменение концентраций в пределах контактной зоны, приходящееся на единицу движущей силы. ЧЕП показывает, сколько единиц вещества переходит в другую фазу при величине движущей силы, равной единице. Рассчитывается по площади на графике 1/(y-yp) от y.
12.ТТ, ВЭТТ
1) ТT – контактное устройство, обеспечивающее получение равновесных потоков фаз, покидающих контактную зону. Одна ТТ – одно изменение концентраций по жидкой фазе и одно изменение по паровой фазе.
ТТ используют при расчетах массообменных аппаратов, когда нужно учитывать время контакта фаз, необходимое для достижения равновесия. Преимуществом метода ТТ является то, что нужно иметь только уравнение равновесия и уравнение рабочей линий. Вместо понятия ТТ используют ЧТТ. ЧТТ зависит от взаимного расположения рабочей и равновесной линии![]() от величины движущей силы процесса. При сближении рабочей и равновесной линии ∆ ↓ → ЧТТ ↑ и наоборот. ЧТТ используется для определения высоты контактной зоны аппарата Н, для этого используют ВЭТТ.
от величины движущей силы процесса. При сближении рабочей и равновесной линии ∆ ↓ → ЧТТ ↑ и наоборот. ЧТТ используется для определения высоты контактной зоны аппарата Н, для этого используют ВЭТТ.
2) ![]() (1) – мат.баланс фазы G в интегральной форме
(1) – мат.баланс фазы G в интегральной форме
![]() (2) – уравнение массопередачи
(2) – уравнение массопередачи
объединяя урав (1) и (2), интегрируем →
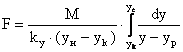 (3) - поверхность фазового контакта
(3) - поверхность фазового контакта
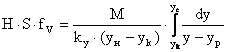 (4) – поверхность массообмена для насадочных аппаратов, где
(4) – поверхность массообмена для насадочных аппаратов, где
![]() - раб.V аппарата*поверхность контакта фаз в 1 его V.
- раб.V аппарата*поверхность контакта фаз в 1 его V.
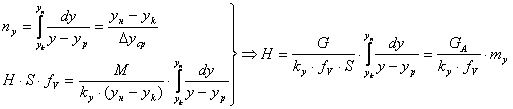 (5) – высота аппарата, где H, S –высота и сечение ап/та, G –расход ф.G [кг/с],
(5) – высота аппарата, где H, S –высота и сечение ап/та, G –расход ф.G [кг/с],![]() -массовая скорость ф.G [
-массовая скорость ф.G [![]() ]
]
из урав (5) →
![]() - высота, эквивалентная одной единице переноса.
- высота, эквивалентная одной единице переноса.
13.Способы выражения составов фаз
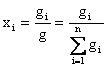 (1) - массовые доли компонентов в жидкой (
(1) - массовые доли компонентов в жидкой (![]() ) и паровой фазе (
) и паровой фазе (![]() ); где g и G-
); где g и G-
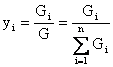 (1) массы жидкой и паровой фаз,
(1) массы жидкой и паровой фаз, ![]() и
и ![]() -компонент жид/пар.фазы.
-компонент жид/пар.фазы.
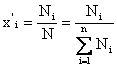 (2) - мольные доли компонентов в жидкой (
(2) - мольные доли компонентов в жидкой (![]() ) и паровой фазе (
) и паровой фазе (![]() ); где
); где ![]()
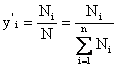 (2)
(2) ![]() -число молей компонента и N-общее число молей смеси.
-число молей компонента и N-общее число молей смеси.
![]() ,
, ![]() ,
, ![]() ,
, ![]()
![]()
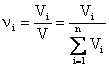 (3) - объемная доля компонента; где
(3) - объемная доля компонента; где ![]() -объем компонента и V-общий объем.
-объем компонента и V-общий объем.
![]() ,
, ![]()
Пересчет массовых и мольных долей:
 и
и  - переход из мольных в массовые доли.
- переход из мольных в массовые доли.
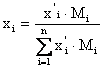 и
и 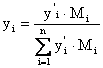 - переход из массовых в мольные доли.
- переход из массовых в мольные доли.
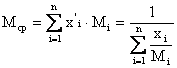 и
и 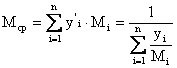 - средняя мольная/массовая масса смеси.
- средняя мольная/массовая масса смеси.
![]() - пересчет массовой доли в объемную.
- пересчет массовой доли в объемную.
![]() - средняя плотность смеси.
- средняя плотность смеси.
![]() - объемная концентрация.
- объемная концентрация.
14.Правило фаз Гиббса
Состояние равновесия характеризуется правилом фаз Гиббса, которое определяет связь между числом степеней свободы, числом ее компонентов и числом фаз.
Число независимых параметров, которые могут быть выбраны произвольно, чтобы привести систему в состояние равновесия – число степеней свободы.
![]() где L – число степеней свободы n – число компонентов N – число фаз
где L – число степеней свободы n – число компонентов N – число фаз
В качестве степеней свободы могут выступать t,P,c
Для 2-х компонентной системы взаимно растворимых жидкостей L=2, а для нерастворимых L=1
Вывод уравнения:
1) Пусть система содержит N фаз и n компонентов в каждой фазе.
2) Состояние фаз фиксировано при Р и Т.
3) Состав каждой фазы можно рассчитать, задавая n-1 концентраций компонентов, а концентрация одного из компонентов является зависимой величиной и может быть рассчитана из условия, что сумма мольных долей всех компонентов в смеси равна 1. ![]()
4) ![]() - общее число переменных, определяющих состояние системы.
- общее число переменных, определяющих состояние системы.
5) ![]() - общее число уравнений для расчета состояния системы, где (N-1) – число уравнений,
- общее число уравнений для расчета состояния системы, где (N-1) – число уравнений,
достаточных для расчета концентрации компонентов, n – число переменных.
6) Число уравнений не может превышать числа переменных, иначе уравнения будут несовместимыми. Разность между числом независимых переменных и числом уравнений равна числу произвольно изменяемых параметров в данной системе, меняя которые можно не менять число фаз в ней (степень свободы):
