Процессы и аппараты в химической технологииРефераты >> Технология >> Процессы и аппараты в химической технологии
![]()
15.Насыщенные и ненасыщенные пары
Насыщенный пар – пар, находящийся в равновесии с жидкостью. Ненасыщенный (перегретый) пар – пар, который при данных Т и Р образует паровую систему без жидкой фазы. Ненасыщенные пары могут существовать при данном давлении, если их температура будет больше температуры насыщенных паров или при данной температуре, если их давление меньше давления насыщенных паров.
| |
 Р
Р
АК- зависимость насыщенных паров от Т.
Каждая точка на кривой АК связывает давление
насыщенных паров с температурой кипения ж-ти.
К Состояние, при котором исчезает различие между
![]() жидкой и газовой фазами – критическое состояние.
жидкой и газовой фазами – критическое состояние.
жидкая фаза ![]() - максимальная Т, при которой жидкая и пар.ф
- максимальная Т, при которой жидкая и пар.ф
Р существуют в равновесии.
С ![]() - Р, при котором вещество может быть в жид.с
- Р, при котором вещество может быть в жид.с
А ненас при ![]() .
.
пар
Т ![]() Т
Т
16.Классификация бинарных смесей жидкостей.
Бинарные смеси делятся на три группы в зависимости от степени их взаимной растворимости:
- нерастворимые
- частично растворимые
- взаимно растворимые: - образующие идеальные растворы
- частично отклоняющиеся от закона Рауля
- неидеальные растворы, значительно отклоняющиеся от закона Рауля
17.Основные законы фазового равновесия
Рассмотрим 3 основных закона фазового равновесия: закон Рауля, закон Дальтона и закон Генри.
1) Закон Рауля:
“Парциальное давление ![]() компонента идеального жидкого раствора равно произведению давления насыщенных паров
компонента идеального жидкого раствора равно произведению давления насыщенных паров ![]() компонента при данной температуре на мольную долю компонента
компонента при данной температуре на мольную долю компонента ![]() в жидкой фазе”.
в жидкой фазе”. ![]()
2) Закон Дальтона:
“Парциальное давление компонента газовой смеси ![]() равно произведению давления в системе π на мольную долю компонента
равно произведению давления в системе π на мольную долю компонента ![]() в газовой смеси”.
в газовой смеси”. ![]()
Закон Дальтона является следствием уравнения Менделеева-Клапейрона:
3) Закон Генри:
“Парциальное давление компонента прямо пропорцииально его мольной концентрации”. Закон справедлив для разбавленных растворов. ![]()
![]() - константа фазового равновесия данного компонента смеси.
- константа фазового равновесия данного компонента смеси.
![]() - для идеальных растворов.
- для идеальных растворов. ![]() компонента).
компонента).
18,19.Равновесие идеальных бинарных смесей, изотерма паровой и жидкой фазы
Рассмотрим случай, когда бинарная смесь образует идеальный раствор, подчиняющийся законам Рауля и Дальтона. Состояние такой системы характеризуется π, t, ![]() ,
, ![]() . L=2 (произвольно определяем 2 параметра).
. L=2 (произвольно определяем 2 параметра).
По закону Рауля парциальные давления определяются:
для НКК - ![]()
для ВКК - ![]()
Общее давление насыщенных паров смеси равно сумме парциальных давлений компонентов:
![]() - уравнение изотермы жидкой фазы, выражает зависимость между составом жидкой и паровой фазы и давлением насыщенных паров этой жидкости
- уравнение изотермы жидкой фазы, выражает зависимость между составом жидкой и паровой фазы и давлением насыщенных паров этой жидкости
Так как жидкость находиться в равновесии с соответствующим нас.паром (t кип) → ![]() →
→
состав жидкой фазы - ![]()
По закону Дальтона парциальное давление в паровой фазе определяется:
для НКК - ![]()
для ВКК - ![]()
При равновесии парциальные давления каждого компонента в паровой и жидкой фазах равны:
![]() =
=![]() (1)
(1)
![]() =
=![]() (1a)
(1a)
из урав (1) и (1а) определяем состав паровой фазы, находящейся в равновесии с жидкостью состава:
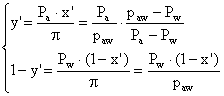 (2)
(2)
из урав (2) →
![]() - уравнение изотермы паровой фазы.
- уравнение изотермы паровой фазы.
При использовании закона Генри:
уравнение изотермы жидкой фазы - ![]() используется для определения температуры кипения смеси при давлении π.
используется для определения температуры кипения смеси при давлении π.
уравнение изотермы паровой фазы - ![]() используется для определения температуры начала конденсации паровой фазы при π.
используется для определения температуры начала конденсации паровой фазы при π.
20.Графический расчет равновесных составов паров и жидкости
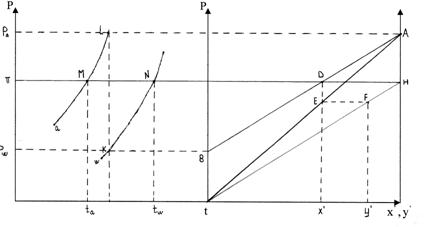
Состав жидкой и паровой фаз можно определить по известным кривым зависимости давления насыщенных паров от температуры.
В точках M и N пересекаются линии заданного внешнего давления π и кривые давления насыщенных паров. В этих точках определяются температуры кипения чистого НКК (![]() ) и ВКК (
) и ВКК (![]() ).
).
При выбранной t, давление нас.паров НКК – т.L, давление нас.паров ВКК – т.K.
Отложив эти значения на правом графике в т.А и в т.В, проводим через них изотерму ВА.
т.D – определяет состав кипящей жидкости ![]() при заданной температуре и давлении π
при заданной температуре и давлении π
ОА – закон Рауля, выражает зависимость между составом жидкой фазы и парциальным давлением НКК.
т.Е – парциальное давление НКК при найденном значении ![]() .
.
