Получение оксидов уранаРефераты >> Технология >> Получение оксидов урана
Уран в растворе
В водном растворе уран образует ионы со степенями окисления +3, +4, +5 и +6. Ионы урана гидратированы и гидролизованы. Уран (III) в растворе находится в виде ионов U3+. Он неустойчив и вступает в реакцию с водой:
![]()
Уран (IV) в растворе находится в виде ионов U4+, которые получаются при растворении тетрагалогенов урана или в результате окисления U3+. U4+-ион неустойчив в растворах, но сильно гидролизован и гидратирован:
![]()
При дальнейшем гидролизе образуются полиядерные соединения вида ![]() . В кислых растворах гидролиз подавляется.
. В кислых растворах гидролиз подавляется.
Действием соответствующих реагентов из раствора, содержащего U4+, выделяются малорастворимые фторид, иодат, оксалат, пирофосфат, гипофосфат, купферонат, гидроксид UIV.
Уран (VI), благодаря высокому заряду и сравнительно небольшому радиусу иона U5+ не может существовать в виде простого иона и в растворе образует оксикатион ураноил UO2+. Он малоустойчив, стабилен лишь при pH = 2,5; при больших pH идет гидролиз, при меньшем – диспропорционирование:
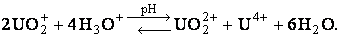
Кроме того, имеет место гидролиз UO2+. Гидроксид UO2OH . xH2O амфотерен. UVI устойчив в неводных растворах.
Уран (VI) в растворе образует вследствие отщепления кислорода от воды оксокатион уранил – UO22+, который получается при окислении урана низших степеней окисления. При гидролизе уранил-иона образуется ряд многоядерных комплексов:

При дальнейшем гидролизе образуется U3O8(OH)2 и затем U3O8(OH)42-.
Определение урана
Для весового определения урана используют осаждение его в виде 8-оксихинолята, диураната аммония или перекиси урана с последующим прокаливанием до U3O8. UIV может быть определен титрованием в кислой среде ванадатом аммония, комплексоном II (ЭДТА) или III с индикатором арсеназо-I. UVI определяют титрованием с комплексоном III с индикатором 1-(2-пиридилазо)-2-нафтолом. Для определения урана широко используют фотометрические методы с использованием арсеназо-I, арсеназо-III и 1-(2-пиридилазо)-резорцина. Для анализа на уран используют также люминесцентный метод.
Применение урана
Уран применяется в качестве ядерного горючего, U238 служит сырьем для получения ядерного горючего Pu239. U235 и U233 являются делящимися материалами. Все другие области применения урана в настоящее время мало существенны.
Некоторые соединения урана
Галогениды. Уран образует большое число соединений с галогенами:
UF3 UF4 UF5 UF6
UCl3 UCl4 UCl5 UCl6
UBr3 UBr4 UBr5
UI3 UI4
Стабильность галогенидов падает с возрастанием порядкового номера галогена и числа атомов галогена в соединении. Кроме того, известны оксигалогениды UO2Г2 и UOГ2.
 |
Трифторид изоморфен фторидам лантана и неодима. Он не растворяется в воде и разбавленных кислотах, медленно растворяется в концентрированных серной, азотной и хлорной кислотах, быстро – в смеси азотной и борной кислот, образуя UO22+. В соляной кислоте идет медленное растворение с образованием U3+.
Тетрафторид UF4 является исходным соединением для получения металлического урана. Хороший метод получения UF4 из перекиси урана осуществляется по схеме:
![]() Холодные кислоты не растворяют тетрафторид, при нагревании с концентрированными серной, ортофосфорной и азотной кислотами он медленно растворяется.
Холодные кислоты не растворяют тетрафторид, при нагревании с концентрированными серной, ортофосфорной и азотной кислотами он медленно растворяется.
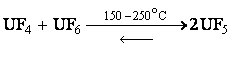 |
Следовательно, пентафторид урана при нагревании диспропорционирует. Его можно получить также при действии фтористого водорода на пентахлорид урана или по реакции между тетрафторидом урана и фтором в необходимых пропорциях при 150–250 °С.
Гексафторид урана UF6 – легколетучее соединение, которое применяют для разделения изотопов урана в газовой фазе. Он не имеет жидкого состояния при атмосферном давлении и возгоняется при 56,5 °С. Давление его пара при комнатной температуре равно 120 мм рт. ст. Гексафторид урана получается действием фтора при температурах выше 220 °С на низшие фториды урана или фторирующих реагентов (AgF2, FeF3, BrF3, ClF3) на уран и его двуокись.
Органические вещества под действием гексафторида урана обугливаются. Устойчивы к нему только полностью фторированные органические соединения.
Тригалогениды UCl3, UBr3 и UI3 образуются при действии свободных галогенов или галогенводородов на уран, но одновременно получаются и тетрагалогениды.
Тригалогениды урана растворяются в воде и реагируют с ней с выделением водорода. В неполярных растворителях они нерастворимы.
Тетрагалогениды UCl4, UBr4 и UI4. Тетрахлорид и тетрабромид получают действием на двуокись урана при 500 °С соответственно четыреххлористого и четырехбромистого углерода или хлора в присутствии графита. Тетраиодид урана получается при действии паров иода на уран при давлении иода 100–200 мм рт. ст.
Все тетрагалогениды (кроме UF4) растворимы в воде, нерастворимы в неполярных растворителях.
Четыреххлористый углерод и сероуглерод растворяют пентахлорид урана. Спирты, эфиры, пиридин и ряд других органических соединений реагируют с пентахлоридом.
