Получение оксидов уранаРефераты >> Технология >> Получение оксидов урана
Диоксид урана, полученный термической диссоциацией оксалата уранила, пирофорен, легко взаимодействует с газообразным фтористым водородом т плавиковой кислотой.
Получение оксидов урана из аммонийуранилтрикарбоната
В этом же интервале температур, но в инертной атмосфере или под вакуумом разложение аммонийуранилтрикарбоната сопровождается образованием диоксида урана:
Восстановление высших оксидов урана до диоксида
Все рассмотренные методы получения оксидов урана давали в основном возможность получить высшие оксиды урана (триоксид и закись-окись урана). Для восстановления этих последних чаще всего используется водород или расщепленный аммиак при повышенных температурах. Прокаливание ниже 1000°С независимо от парциального давления кислорода приводит к образованию окисла урана состава UO2,61 – 2,64. Скорость отщепления кислорода от триоксида урана зависит от температуры (табл. 4). В течение всего процесса прокаливания эта скорость остается примерно постоянной. Следует отметить, что дальнейшее повышение температуры уже меньше сказывается на изменении скорости реакции, в связи с чем при производстве закиси-окиси урана поддерживают температуру около 800°С.
Таблица 4. Зависимость скорости отщепления кислорода
при прокаливании триоксида урана на воздухе от температуры
|
Температура, °С |
Скорость отщепления кислорода, моль О2/моль U/мин |
|
500 |
0,007 |
|
590 |
0,031 |
|
640 |
0,086 |
|
800 |
0,192 |
Скорость реакции восстановления закиси-окиси урана водородом зависит прежде всего от температуры (табл. 5).
Таблица 5. Влияние температуры на скорость реакции
восстановления закиси-окиси урана водородом
|
Температура, °С |
Скорость реакции восстановления, моль Н2/моль U/мин |
|
450 |
0,0021 |
|
470 |
0,0034 |
|
496 |
0,0067 |
|
525 |
0,0135 |
|
581 |
0,0320 |
|
597 |
0,0371 |
|
649 |
0,0467 |
|
705 |
0,0490 |
|
866 |
0,0473 |
Примечание. Реакция восстановления проведена при постоянном парциальном давлении водорода 400 мм рт. ст.; закись-окись урана получена ступенчатым прокаливанием пероксида урана при 250 –300°С до UO3 . 1/2H2O, а затем при 800°С до U3O8.
Начиная с температуры 650°С, скорость реакции больше не увеличивается, поэтому процесс восстановления закиси-окиси урана водородом целесообразно проводить в интервале температур 600 – 700°С, при этом парциальное давление водорода и степень восстановления закиси-окиси также оказывают влияние. С повышением парциального давления водорода скорость реакции восстановления закиси-окиси урана повышается, но сравнительно слабо, поэтому процесс проводится при давлении, близком к атмосферному.
Размер кристаллов закиси-окиси урана также влияет на скорость восстановления (табл. 6).
Таблица 6. Зависимость скорости восстановления закиси-окиси урана
водородом от среднего размера кристаллов
|
Соединение, из которого получена закись-окись урана |
Температура получения закиси-окиси урана, °С |
Средний размер кристаллов, мкм |
Скорость восстановления закиси-окиси урана при 380°С, мольН2/мольU/мин. |
Скорость восстановления закиси-окиси урана при 545°С, моль Н2/мольU/мин. |
|
UO2C2O4 |
<650 |
~0,1 |
0,0023 |
0,036 |
|
(NH4)2U2O7 |
650 |
~0,3 |
0,0010 |
0,057 |
|
UO4 . 2H2O |
800 |
~0,5 |
0,0002 |
0,019 |
Примечание. Восстановление проведено при постоянном парциальном давлении водорода 400 мм рт. ст.
С уменьшением среднего размера кристаллов закиси-окиси урана возрастает скорость восстановления; только лишь для очень тонкодисперсных материалов, для которых характерно спекание частиц при повышенных температурах, этот эффект несколько смазывается.
Для закиси-окиси урана, полученной при прокаливании триоксида урана в интервале температур 700 –800°С, реакция ее восстановления водородом имеет первый порядок и константа скорости реакции может быть вычислена по уравнению:
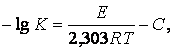
где К – константа скорости реакции, л/мин;
Е – энергия активации реакции, равная 34,2±2.3 ккал/моль;
